Page mise à jour le 15 janvier 2024
EPP cartographie de l’informatisation des DMI
Contactez l’OMéDIT !
DM intra-GHS et recueil PMSI- Webinaires
Suite à la parution de la note d’information du 22 décembre 2021 relative à la réglementation applicable au 01 avril 2022 des modalités du recueil dans le PMSI des données des DM Intra GHS, 2 webinaires sur cette thématique se sont tenus les 5 et 8 avril 2022 en animation et partenariat COTRIM-OMEDIT -ARS HDF.
Vous trouverez ci-après la présentation support des webinaires
Un guide reprenant les modalités du recueil dans le PMSI des données des DM Intra GHS a été réalisé par le COTRIM HDF et disponible –>
Les Replay sont désormais mis à disposition sur notre chaîne You Tube.
Replay du webinaire disponible
La chaine You tube de l’Omedit Hauts de France est désormais fonctionnelle. Vous y trouverez le replay des webinaires d’Avril sur les DM intraGHS
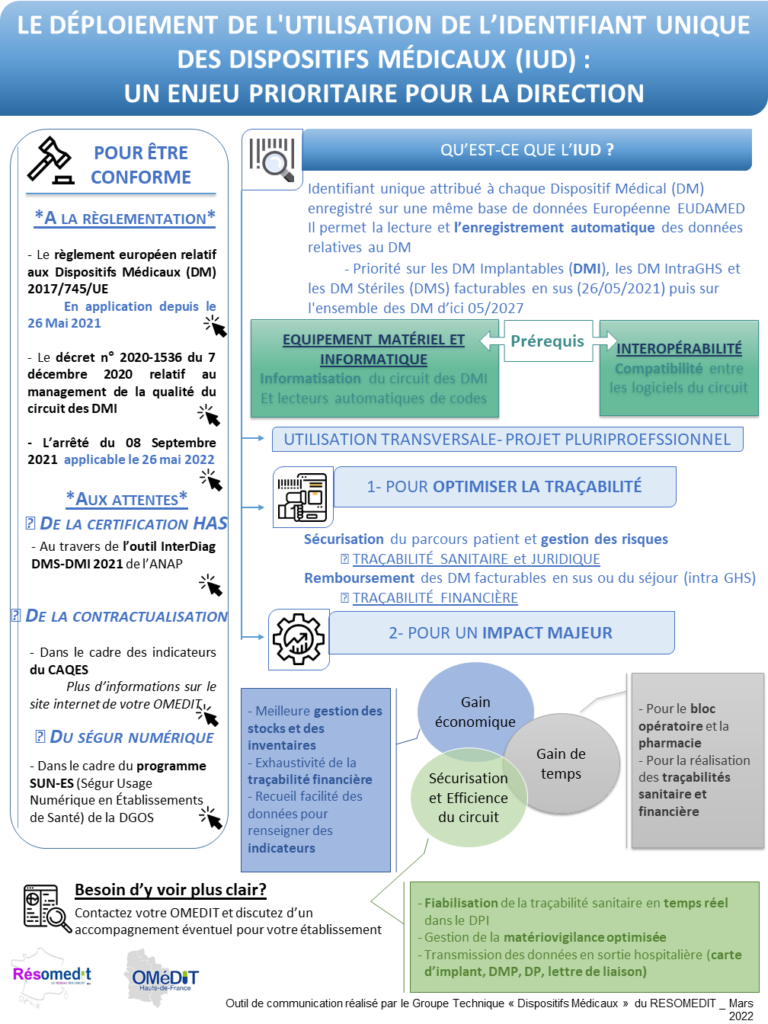
RESOMEDIT - Outil d'aide au déploiement de l'IUD

Entrée en application du Règlement (UE) 2017/745 sur les dispositifs médicaux
Parution du guide actualisé réalisé par EuroPharmat sur l’impact du règlement sur les établissements de santé

Enquête nationale sur l’informatisation de la traçabilité sanitaire des dispositifs médicaux implantables
Identification individuelle pour une inscription en ligne générique des dispositifs médicaux
Identification individuelle pour une inscription en ligne générique des dispositifs médicaux
=> avec la base de données des codes d’identification individuelle pour une inscription en ligne générique du 6 janvier 2020
Pour rappel, « la prise en charge au titre de la liste des produits et prestations (LPP) mentionnée à l’article L. 165-1 du code de la sécurité sociale (CSS) évolue. Les fabricants et les distributeurs doivent désormais détenir, en vue du remboursement, un code permettant l’identification de leurs produits. »
« En fonction du type de dispositif médical, un code doit être détenu par le fabricant au plus tard selon le calendrier suivant (cf. décret n° 2019-571 du 11 juin 2019) :
– 1er novembre 2019 pour les titres 3 et 5 ;
– 1er décembre 2019 pour les titres 2 et 4 ;
– 1er janvier 2020 pour le titre 1. »
« En raison du nombre important de dossiers reçus et du délai de traitement nécessaire à l’attribution des codes individuels, nous souhaitons vous informer qu’une tolérance sera accordée entre les dates prévues par le décret ci-dessus et les nouvelles dates ci-dessous. Cette tolérance permettra la facturation et la prise en charge des dispositifs médicaux concernés avec l’un ou l’autre des deux codes LPP, génériques (actuels) ou identifiants individuels (à venir).
Les obligations réglementaires relatives aux dépôts de demande perdurent, les entreprises doivent donc impérativement avoir demandé un code aux dates indiquées dans le décret.
La coexistence des deux codes sera permise jusqu’aux dates suivantes :
– Pour les titres 3 et 5 : jusqu’au 1er janvier 2020
– Pour les titres 1, 2 et 4 : jusqu’au 1er avril 2020
– Pour les nomenclatures en cours de modifications (Optique médicale et Grand Appareillage Orthopédique) : jusqu’au 1er juillet 2020.
Au-delà de ces dates, la prise en charge sur les anciens codes ne sera plus possible. Il convient donc que chaque fabricant ait communiqué à ses distributeurs son code LPP d’identification individuelle. »

