JORF n°0238 du 12 octobre 2021 Texte n° 26
Arrêté du 8 octobre 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3188151 | Implants vasculaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel de la République française.
JORF n°0238 du 12 octobre 2021 Texte n° 25
Arrêté du 8 octobre 2021 portant inscription de l’endoprothèse carotidienne auto-expansible CGUARD Embolic Prevention System (EPS) de la société InspireMD au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0238 du 12 octobre 2021 Texte n° 24
Arrêté du 8 octobre 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3126026 | Implants vasculaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel de la République française.
JORF n°0238 du 12 octobre 2021 Texte n° 23
Arrêté du 8 octobre 2021 portant inscription de l’endoprothèse carotidienne auto-expansible CASPER de la société MICROVENTION Europe au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0238 du 12 octobre 2021 Texte n° 22
Arrêté du 8 octobre 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3117783 | Implants vasculaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel de la République française.
JORF n°0238 du 12 octobre 2021 Texte n° 21
Arrêté du 8 octobre 2021 portant inscription de l’endoprothèse carotidienne auto-expansible ROADSAVER des Laboratoires TERUMO France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0235 du 8 octobre 2021 Texte n° 40
Arrêté du 6 octobre 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La spécialité suivante est inscrite sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– en monothérapie ou en association à la dexaméthasone, dans le traitement des patients adultes atteints de myélome multiple en progression, ayant reçu au moins 1 traitement antérieur et ayant déjà bénéficié ou étant inéligibles à une greffe de cellules souches hématopoïétiques ;
– en association au melphalan et à la prednisone, est indiqué pour le traitement des patients adultes atteints de myélome multiple non traité au préalable, non éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association à la dexaméthasone, ou à la dexaméthasone et au thalidomide, est indiqué pour le traitement d’induction des patients adultes atteints de myélome multiple non traité au préalable, éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques.
Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
bortezomib | BORTEZOMIB SUN 3,5 mg, poudre pour solution injectable | 3400890015202 | BORTEZOMIB SUN 3,5MG INJ FL | SUN PHARMA FRANCE |
JORF n°0235 du 8 octobre 2021 Texte n° 39
Arrêté du 6 octobre 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une recommandation temporaire d’utilisation et pris en application de l’article L. 162-17-2-1 du code de la sécurité sociale dans sa rédaction en vigueur avant le 1er juillet 2021
En application de l’article L. 162-17-2-1 du code de la sécurité sociale dans sa rédaction en vigueur avant le 1er juillet 2021 et dans le cadre de la recommandation temporaire d’utilisation dont elle fait l’objet, la spécialité pharmaceutique mentionnée en annexe du présent arrêté est prise en charge, pour une durée de trois ans, dans l’indication mentionnée dans ladite annexe.
La spécialité pharmaceutique disposant d’une recommandation temporaire d’utilisation inscrite sur la liste prévue à l’article L. 5126-6 du code de la santé publique qui figurent en annexe est prise en charge par l’assurance maladie conformément à l’article L. 162-17, deuxième alinéa, du code de la sécurité sociale. Cette annexe précise la seule indication thérapeutique ouvrant droit à la prise en charge ou au remboursement de cette spécialité sur ladite liste.
La prescription de BERINERT® est réservée aux spécialistes hospitaliers en transplantation rénale, cardiaque ou pulmonaire ou médecins ayant des compétences dans le suivi des patients transplantés.
L’entreprise exploitant la spécialité pharmaceutique figurant en annexe est tenue de mettre en place le suivi des patients selon les modalités prévues dans le protocole mentionné à l’article R. 5121-76-1 du code de la santé publique dans sa rédaction en vigueur avant le 1er juillet 2021.
ANNEXE
(1 spécialité)
La spécialité suivante est prise en charge au titre de l’article L. 162-17-2-1 du code de la sécurité sociale dans sa rédaction en vigueur avant le 1er juillet 2021 dans l’indication thérapeutique suivante :
– Traitement de sauvetage des épisodes de rejet humoral réfractaire au traitement standard chez les patients transplantés cardiaques, rénaux ou pulmonaires qui ne peuvent pas participer à l’étude clinique NCT03221842, et associé aux traitements standards à base d’immunoglobuline intraveineuse (IgIV) et échanges plasmatiques.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
Inhibiteur de la C1 estérase | BERINERT 500 UI mg, poudre et solvant pour solution injectable /perfusion | 3400892680811 | BERINERT 500UI INJ F+F | CSL Behring |
JORF n°0235 du 8 octobre 2021 Texte n° 38
Arrêté du 6 octobre 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La spécialité suivante est inscrite sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie est, pour la spécialité visée ci-dessous :
– indiqué en monothérapie comme traitement de fond des formes très actives de sclérose en plaques (SEP) rémittente-récurrente chez les patients adultes âgés de 18 ans et plus présentant une forme très active de la maladie malgré un traitement par interféron bêta. Ces patients peuvent être définis comme n’ayant pas répondu à un traitement complet et bien conduit par interféron bêta (habituellement d’une durée d’au moins un an). Les patients doivent avoir présenté au moins 1 poussée au cours de l’année précédente alors qu’ils étaient sous traitement et doivent présenter au moins 9 lésions hyperintenses en T2 à l’IRM cérébrale ou au moins 1 lésion rehaussée après injection de Gadolinium.Un « non répondeur » peut également être défini comme un patient dont le taux de poussées n’a pas changé ou a augmenté par rapport à l’année précédente ou qui continue à présenter des poussées sévères ;
– indiqué en monothérapie comme traitement de fond des formes très actives de sclérose en plaques (SEP) rémittente-récurrente chez les patients âgés de 18 ans et plus présentant une sclérose en plaques rémittente-récurrente sévère et d’évolution rapide, définie par 2 poussées invalidantes ou plus au cours d’une année associées à 1 ou plusieurs lésion(s) rehaussée(s) après injection de Gadolinium sur l’IRM cérébrale ou une augmentation significative de la charge lésionnelle en T2 par rapport à une IRM antérieure récente.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
NATALIZUMAB | TYSABRI 150 mg, solution injectable en seringue préremplie | 3400890012997 | TYSABRI 150MG INJ SRG1ML | BIOGEN FRANCE SAS |
JORF n°0235 du 8 octobre 2021 Texte n° 36
Arrêté du 4 octobre 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, le code suivant est radié :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 2, section 1, sous-section 1 | 3261103 | Bioprothèses valvulaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel de la République française.
JORF n°0235 du 8 octobre 2021 Texte n° 35
Arrêté du 4 octobre 2021 portant radiation de produits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale, au chapitre 2, section 1, sous-section 1, au paragraphe 2 : « Bioprothèses valvulaires par voie transcutanée », dans la rubrique « Société BOSTON SCIENTIFIC (BOSTON) », le code suivant est radié :
CODE | LIBELLÉ |
|---|---|
3261103 | Bioprothèse valvulaire, transcutanée, aortique, BOSTON, LOTUS EDGE. |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0235 du 8 octobre 2021 Texte n° 34
Arrêté du 4 octobre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
(1 inscription)
La spécialité pharmaceutique suivante inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 550 803 8 1 | TYSABRI 150 mg (natalizumab), solution injectable en seringue préremplie, seringue préremplie (verre) de 1 ml (150 mg/ml), boîte de 2 seringues préremplies (B/2) (laboratoires BIOGEN FRANCE SAS) |
(1 modification)
Le libellé de la spécialité pharmaceutique suivante est modifié comme suit.
Ancien libellé | Nouveau libellé | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 569 967 7 3 | TYSABRI 300 mg (natalizumab), solution à diluer pour perfusion, 15 ml en flacon (B/1) (Laboratoires BIOGEN IDEC FRANCE) | 34009 569 967 7 3 | TYSABRI 300 mg (natalizumab), solution à diluer pour perfusion, 15 ml en flacon (B/1) (Laboratoires BIOGEN FRANCE SAS) |
JORF n°0235 du 8 octobre 2021 Texte n° 33
Arrêté du 4 octobre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(10 inscriptions)
I. – La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité ci-dessous :
– traitement du cancer du sein, localement avancé ou métastasé, chez la femme ménopausée possédant des récepteurs aux estrogènes positifs, en cas de récidive pendant ou après un traitement adjuvant par un anti-estrogène ou de progression de la maladie sous traitement par anti-estrogène.
Code CIP | Présentation |
|---|---|
34009 301 165 3 1 | FULVESTRANT REDDY PHARMA 250 mg, solution injectable, 5 ml en seringue pré-remplie avec 1 aiguille protégée (B/1) (laboratoires REDDY PHARMA SAS) |
II. – Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 280 7 4 | BORAX/ACIDE BORIQUE EG 12 mg/18 mg/ml, solution pour lavage ophtalmique, 5 ml en récipient unidose (B/20) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 186 5 5 | IBUPROFENE ARROW LAB 200 mg, comprimés enrobés (B/30) (laboratoires ARROW GENERIQUES) |
34009 302 313 7 1 | LISINOPRIL ARROW LAB 20 mg, comprimés (B/28) (laboratoires ARROW GENERIQUES) |
34009 302 313 8 8 | LISINOPRIL ARROW LAB 20 mg, comprimés (B/84) (laboratoires ARROW GENERIQUES) |
34009 302 329 6 5 | PERINDOPRIL/INDAPAMIDE ZENTIVA 4 mg/1,25 mg, comprimés sécables (B/30) (laboratoires ZENTIVA FRANCE) |
34009 302 329 7 2 | PERINDOPRIL/INDAPAMIDE ZENTIVA 4 mg/1,25 mg, comprimés sécables (B/90) (laboratoires ZENTIVA FRANCE) |
34009 302 227 5 1 | PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/ 50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires ARROW GENERIQUES) |
34009 302 227 6 8 | PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 250 microgrammes/ 50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires ARROW GENERIQUES) |
34009 302 227 7 5 | PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 500 microgrammes/ 50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires ARROW GENERIQUES) |
SECONDE PARTIE
(1 modification)
Le libellé de la spécialité pharmaceutique suivante est modifié comme suit :
Libellé abrogé | Nouveau libellé | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 300 022 9 2 | AMOROLFINE RANBAXY 5 %, vernis à ongles médicamenteux, 2,5 ml en flacon (verre type III) avec 10 spatules (B/1) (Laboratoires SUBSTIPHARM) | 34009 300 022 9 2 | AMOROLFINE SUBSTIPHARM 5 %, vernis à ongles médicamenteux, 2,5 ml en flacon (verre type III) avec 10 spatules (B/1) (Laboratoires SUBSTIPHARM) |
JORF n°0235 du 8 octobre 2021 Texte n° 31
Arrêté du 4 octobre 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La spécialité pharmaceutique rétrocédable suivante est prise en charge par l’Assurance-Maladie.
Les seules indications thérapeutiques ouvrant droites à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– en monothérapie ou en association avec la dexaméthasone, pour le traitement des patients adultes atteints de myélome multiple en progression, ayant reçu au moins 1 traitement antérieur et ayant déjà bénéficié ou étant inéligibles à une greffe de cellules souches hématopoïétiques ;
– en association avec le melphalan et la prednisone, pour le traitement des patients adultes atteints de myélome multiple non traité au préalable, non éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec la dexaméthasone, ou avec la dexaméthasone et la thalidomide, pour le traitement d’induction des patients adultes atteints de myélome multiple non traité au préalable, éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec le rituximab, le cyclophosphamide, la doxorubicine et la prednisone, pour le traitement des patients adultes atteints d’un lymphome à cellules du manteau non traité au préalable et qui ne sont pas éligibles à une greffe de cellules souches hématopoïétiques.
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 900 152 0 2 | BORTEZOMIB SUN 3,5MG INJ FL | SUN PHARMA FRANCE |
JORF n°0235 du 8 octobre 2021 Texte n° 30
Arrêté du 4 octobre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visées ci-dessous :
– en monothérapie ou en association avec la dexaméthasone, pour le traitement des patients adultes atteints de myélome multiple en progression, ayant reçu au moins 1 traitement antérieur et ayant déjà bénéficié ou étant inéligibles à une greffe de cellules souches hématopoïétiques ;
– en association avec le melphalan et la prednisone, pour le traitement des patients adultes atteints de myélome multiple non traité au préalable, non éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec la dexaméthasone, ou avec la dexaméthasone et au thalidomide, pour le traitement d’induction des patients adultes atteints de myélome multiple non traité au préalable, éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec le rituximab, le cyclophosphamide, la doxorubicine et la prednisone, pour le traitement des patients adultes atteints d’un lymphome à cellules du manteau non traité au préalable et qui ne sont pas éligibles à une greffe de cellules souches hématopoïétiques.
Code CIP | Présentation |
|---|---|
34009 302 281 6 6 | BORTEZOMIB SUN 3,5 mg, poudre pour solution injectable, flacon (verre) (B/1) (laboratoires SUN PHARMA FRANCE) |
JORF n°0232 du 5 octobre 2021 Texte n° 20
Arrêté du 29 septembre 2021 relatif à l’arrêt de la prise en charge de spécialités pharmaceutiques au titre de l’article L. 162-16-5-1-1 du code de la sécurité sociale dans sa rédaction antérieure au 1er juillet 2021
Il est mis fin, à compter du 25 septembre 2021, à la prise en charge mentionnée au I de l’article L. 162-16-5-1-1 du code de la sécurité sociale, dans sa rédaction antérieure au 1er juillet 2021, de la spécialité pharmaceutique mentionnée ci-dessous :
Spécialité pharmaceutique | Indication thérapeutique | Code UCD 7 | Libellé de l’UCD | Laboratoire exploitant |
|---|---|---|---|---|
SIRDALUD 4 mg, comprimé sécable | Traitement de la spasticité due à des troubles neurologiques d’origine cérébrale ou médullaire en cas d’échec ou d’intolérance aux autres traitements antispastiques. | 9300175 | SIRDALUD 4MG CPR | Novartis Pharma SAS |
JORF n°0231 du 3 octobre 2021 Texte n° 12
Arrêté du 30 septembre 2021 modifiant l’arrêté du 19 avril 2021 relatif à l’expérimentation pour l’incitation à la prescription hospitalière de médicaments biologiques délivrés en ville
JORF n°0229 du 1 octobre 2021 Texte n° 15
Arrêté du 27 septembre 2021 subordonnant la prise en charge d’un médicament par l’assurance maladie au recueil et à la transmission de certaines informations relatives à sa prescription, en application de l’article L. 162-17-1-2 du code de la sécurité sociale
JORF n°0228 du 30 septembre 2021 Texte n° 50
Arrêté du 29 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 6. Autres médicaments, la spécialité suivante est ajoutée, pour une durée déterminée de 1 an à partir de la date de publication du présent arrêté :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
ARIKAYCE liposomal 590 mg dispersion pour inhalation par nébuliseur | INSMED NETHERLANDS BV | 6 515 680 5 | 9399995 | ARIKAYCE 590MG INHAL NEB FL |
JORF n°0228 du 30 septembre 2021 Texte n° 49
Arrêté du 28 septembre 2021 portant classement sur les listes des substances vénéneuses
Sont classées sur la liste I des substances vénéneuses les substances suivantes sous toutes leurs formes :
– acalabrutinib ;
– avapritinib ;
– crizanlizumab ;
– dapivirine ;
– entrectinib ;
– filgotinib ;
– glasdégib ;
– imlifidase ;
– léfamuline ;
– luspatercept ;
– remdésivir.
Sont classés sur la liste I des substances vénéneuses les médicaments homéopathiques lorsqu’ils sont administrés par voie parentérale.
JORF n°0228 du 30 septembre 2021 Texte n° 48
Arrêté du 28 septembre 2021 portant classement sur les listes des substances vénéneuses
Sont classées sur la liste I des substances vénéneuses les substances suivantes sous toutes leurs formes :
– acide gadotexique,
– atidarsagène autotemcel,
– bérotralstat,
– baloxavir marboxil,
– bulévirtide,
– cabotégravir,
– cellules autologues CD3+ transduites anti-CD19,
– cénobamate.
– dostarlimab,
– duvélisib,
– élexacaftor,
– élivaldogène autotemcel,
– éravacycline,
– estétrol,
– évinacumab,
– fédratinib,
– fostemsavir trométamol,
– méthacholine,
– MVA-BN-Filo,
– icosapent éthyl,
– inclisiran,
– odévixibat,
– ozanimod,
– pémigatinib,
– ponésimod,
– prétomanid,
– rélugolix,
– rémimazolam,
– risdiplam,
– satralizumab,
– sélinexor,
– selpercatinib,
– sélumétinib,
– setmélanotide,
– somapacitan,
– tagraxofusp,
– tirbanibuline,
– tralokinumab,
– tucatinib,
– vériciguat.
Sont classées sur la liste I des substances vénéneuses les spécialités pharmaceutiques suivantes disposant de l’autorisation de mise sur le marché prévue à l’article L. 5121-8 du code de la santé publique : SIBNAYAL, granulés à libération prolongée.
JORF n°0228 du 30 septembre 2021 Texte n° 46
Arrêté du 28 septembre 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
L’indication thérapeutique ouvrant droit à la prise en charge en sus par l’assurance maladie est, pour les spécialités visées ci-dessous :
– le traitement des patients adultes atteints de la maladie de Castleman (MC) multicentrique, non infectés par le virus de l’immunodéficience humaine (VIH) et l’herpès-virus humain 8 (HHV-8).
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
siltuximab | SYLVANT 100 mg, poudre pour solution à diluer pour perfusion | 3400894099086 | SYLVANT 100MG PERF FL | EUSA PHARMA FRANCE SAS |
siltuximab | SYLVANT 400 mg, poudre pour solution à diluer pour perfusion | 3400894099147 | SYLVANT 400MG PERF FL | EUSA PHARMA FRANCE SAS |
JORF n°0228 du 30 septembre 2021 Texte n° 45
Arrêté du 28 septembre 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 3, sous-section 1, paragraphe 4 | 3104007, 3111674 | Implants articulaires de hanche |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0228 du 30 septembre 2021 Texte n° 44
Arrêté du 28 septembre 2021 portant inscription et modification des conditions d’inscription des cotyles à double mobilité DUALIS TRIPOD et des inserts de la société Gruppo BIOIMPIANTI au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0228 du 30 septembre 2021 Texte n° 43
Arrêté du 27 septembre 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La spécialité suivante est inscrite sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– le traitement des saignements et prophylaxie périopératoire chez des patients présentant une hypo- ou afibrinogènémie congénitale, avec une tendance aux saignements.
– le traitement complémentaire dans la prise en charge d’une hémorragie sévère incontrôlée chez les patients présentant une hypofibrinogènémie acquise au cours d’une intervention chirurgicale.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
fibrinogène humain | FIBRYGA 1g, poudre et solvant pour solution injectable/pour perfusion | 3400894293194 | FIBRYGA 1G INJ FL+FL50ML +NEC | OCTAPHARMA |
JORF n°0228 du 30 septembre 2021 Texte n° 42
Arrêté du 27 septembre 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La prise en charge en sus des prestations d’hospitalisation de la spécialité ci-dessous est étendue à l’indication suivante :
– le traitement des patients adultes atteints d’un carcinome hépatocellulaire avancé ou non résécable, n’ayant pas reçu de traitement systémique antérieur, avec une fonction hépatique préservée (stade Child-Pugh A), un score ECOG 0 ou 1, et non éligibles aux traitements locorégionaux ou en échec à l’un de ces traitements.
Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
Atezolizumab | TECENTRIQ 1200 mg, solution à diluer pour perfusion | 3400894312628 | TECENTRIQ 1200MG PERF FL20ML | ROCHE |
JORF n°0228 du 30 septembre 2021 Texte n° 40
Arrêté du 8 septembre 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La spécialité pharmaceutique rétrocédable suivante est prise en charge par l’assurance maladie.
Les indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– traitement des saignements et prophylaxie périopératoire chez des patients présentant une hypo- ou afibrinogènémie congénitale, avec une tendance aux saignements ;
– traitement complémentaire dans la prise en charge d’une hémorragie sévère incontrôlée chez les patients présentant une hypofibrinogènémie acquise au cours d’une intervention chirurgicale.
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 942 931 9 4 | FIBRYGA 1G INJ FL+FL50ML +NEC | OCTAPHARMA FRANCE |
JORF n°0228 du 30 septembre 2021 Texte n° 39
Arrêté du 26 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– en association au bevacizumab dans le traitement des patients adultes atteints d’un carcinome hépatocellulaire (CHC) avancé ou non résécable, n’ayant pas reçu de traitement systémique antérieur uniquement chez les patients avec une fonction hépatique préservée (stade Child-Pugh A), un score ECOG 0 ou 1, et non éligibles aux traitements locorégionaux ou en échec à l’un de ces traitements.
Code CIP | Présentation |
|---|---|
34009 550 420 0 6 | TECENTRIQ 1 200 mg (atezolizumab), solution à diluer pour perfusion, flacon (verre) de 20 ml (60 mg/ml) (B/1) (laboratoires ROCHE) |
JORF n°0228 du 30 septembre 2021 Texte n° 38
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– traitement des saignements et prophylaxie périopératoire chez des patients présentant une hypo- ou afibrinogènémie congénitale, avec une tendance aux saignements ;
– traitement complémentaire dans la prise en charge d’une hémorragie sévère incontrôlée chez les patients présentant une hypofibrinogènémie acquise au cours d’une intervention chirurgicale.
Code CIP | Présentation |
|---|---|
34009 302 111 6 8 | FIBRYGA 1 g (fibrinogène humain), poudre et solvant pour solution injectable/pour perfusion, 1 flacon de 1 g de fibrinogène humain + 1 flacon de 50 ml de solvant (eau pour préparations injectables) (laboratoires OCTAPHARMA FRANCE) |
JORF n°0227 du 29 septembre 2021 Texte n° 34
Arrêté du 27 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
1) Au 1 « Médicaments dérivés du sang », les spécialités suivantes sont ajoutées :
NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
ATENATIV 50 UI/mL, poudre et solvant pour solution pour perfusion | OCTAPHARMA FRANCE | 6 983 549 7 | 9438726 | ATENATIV 50UI/ML INJ F+F10ML |
ATENATIV 50 UI/mL, poudre et solvant pour solution pour perfusion | OCTAPHARMA FRANCE | 6 983 549 7 | 9433551 | ATENATIV 50UI/ML INJ F+F20ML |
COAGADEX 250 UI, poudre et solvant pour solution injectable | CEVIDRA | 6 434 355 6 | 9001425 | COAGADEX 250UI INJ FL+FL |
COAGADEX 500 UI, poudre et solvant pour solution injectable | CEVIDRA | 6 802 820 9 | 9001427 | COAGADEX 500UI INJ FL+FL |
2) Au 6 « Autres médicaments », les spécialités suivantes sont ajoutées :
NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
ICATIBANT ZENTIVA 30 mg, solution injectable en seringue préremplie | ZENTIVA FRANCE | 6 204 450 9 | 9001702 | ICATIBANT ZEN 30MG INJ SRG3ML |
LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal | EG LABO – LABORATOIRES EUROGENERICS | 6 407 986 8 | 9001654 | LECIGIMON GEL INTEST CAS47ML |
TREPOSUVI® 1 mg/ml, solution pour perfusion | ORPHA DEVEL HANDELS&VERTRIEBS | 6 861 533 8 | 9001713 | TREPOSUVI 1MG/ML PERF FL10ML |
TREPOSUVI® 2,5 mg/ml, solution pour perfusion | ORPHA DEVEL HANDELS&VERTRIEBS | 6 085 657 9 | 9001714 | TREPOSUVI 2,5MG/ML PERF F10ML |
TREPOSUVI® 5 mg/ml, solution pour perfusion | ORPHA DEVEL HANDELS&VERTRIEBS | 6 928 786 2 | 9001715 | TREPOSUVI 5MG/ML PERF FL10ML |
TREPOSUVI® 10 mg/ml, solution pour perfusion | ORPHA DEVEL HANDELS&VERTRIEBS | 6 086 052 4 | 9001712 | TREPOSUVI 10MG/ML PERF FL10ML |
JORF n°0227 du 29 septembre 2021 Texte n° 33
Arrêté du 27 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
1) Au 2 « Antirétroviraux », les spécialités suivantes sont radiées (AMM abrogées) :
| NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
| VIDEX 25 mg, comprimé à croquer ou dispersible | BRISTOL MYERS SQUIBB | 6 513 791 5 | 9153722 | VIDEX 25 MG CPR DISP. |
| VIDEX 50 mg, comprimé à croquer ou dispersible | BRISTOL MYERS SQUIBB | 6 945 754 2 | 9153739 | VIDEX 50 MG CPR DISP. |
| VIDEX 100 mg, comprimé à croquer ou dispersible | BRISTOL MYERS SQUIBB | 6 263 246 2 | 9153691 | VIDEX 100 MG CPR DISP. |
| VIDEX 150 mg, comprimé à croquer ou dispersible | BRISTOL MYERS SQUIBB | 6 820 071 2 | 9153716 | VIDEX 150 MG CPR DISP. |
| VIDEX 125 mg, gélule gastro-résistante | BRISTOL MYERS SQUIBB | 6 817 303 7 | 9217362 | VIDEX 125 MG GELU. |
| VIDEX 200 mg, gélule gastro-résistante | BRISTOL MYERS SQUIBB | 6 712 845 9 | 9217379 | VIDEX 200 MG GELU. |
| VIDEX 250 mg, gélule gastro-résistante | BRISTOL MYERS SQUIBB | 6 281 726 5 | 9217385 | VIDEX 250 MG GELU. |
| VIDEX 400 mg, gélule gastro-résistante | BRISTOL MYERS SQUIBB | 6 555 619 0 | 9217391 | VIDEX 400 MG GELU. |
| VIDEX 2 g, poudre pour solution buvable en flacon | BRISTOL MYERS SQUIBB | 6 388 220 9 | 9157364 | VIDEX 2 G PDR BUV FL. |
| ZERIT 20 mg, gélule | BRISTOL MYERS SQUIBB | 6 535 578 9 | 9177585 | ZERIT 20 MG GELU. |
| ZERIT 30 mg, gélule | BRISTOL MYERS SQUIBB | 6 174 882 7 | 9177591 | ZERIT 30 MG GELU. |
| ZERIT 40 mg, gélule | BRISTOL MYERS SQUIBB | 6 422 714 2 | 9177616 | ZERIT 40 MG GELU. |
| ZERIT 200 mg, poudre pour solution buvable | BRISTOL MYERS SQUIBB | 6 053 638 3 | 9185946 | ZERIT 1 MG/ML BUV PDR FL 200 ML. |
2) Au 3 « Médicaments des hépatites B ou C chroniques », les spécialités suivantes sont radiées (AMM abrogées) :
| NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
| DAKLINZA 30 mg, comprimé pelliculé | BRISTOL MYERS SQUIBB | 6 252 665 1 | 9402846 | DAKLINZA 30 MG CPR PELLIC |
| DAKLINZA 60 mg, comprimé pelliculé | BRISTOL MYERS SQUIBB | 6 481 723 9 | 9402852 | DAKLINZA 60 MG CPR PELLIC |
JORF n°0227 du 29 septembre 2021 Texte n° 32
Arrêté du 27 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 Anticancéreux, les spécialités suivantes sont ajoutées :
| NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
| LENALIDOMIDE REDDY PHARMA 2,5 mg, gélule | REDDY PHARMA SAS | 6 567 705 3 | 9001684 | LENALIDOMIDE RYP 2,5MG GELU |
| LENALIDOMIDE REDDY PHARMA 5 mg, gélule | REDDY PHARMA SAS | 6 888 533 7 | 9001688 | LENALIDOMIDE RYP 5MG GELU |
| LENALIDOMIDE REDDY PHARMA 7,5 mg, gélule | REDDY PHARMA SAS | 6 426 883 3 | 9001689 | LENALIDOMIDE RYP 7,5MG GELU |
| LENALIDOMIDE REDDY PHARMA 10 mg, gélule | REDDY PHARMA SAS | 6 800 161 4 | 9001682 | LENALIDOMIDE RYP 10MG GELU |
| LENALIDOMIDE REDDY PHARMA 15 mg, gélule | REDDY PHARMA SAS | 6 505 065 2 | 9001683 | LENALIDOMIDE RYP 15MG GELU |
| LENALIDOMIDE REDDY PHARMA 20 mg, gélule | REDDY PHARMA SAS | 6 748 214 8 | 9001686 | LENALIDOMIDE RYP 20MG GELU |
| LENALIDOMIDE REDDY PHARMA 25 mg, gélule | REDDY PHARMA SAS | 6 408 461 6 | 9001687 | LENALIDOMIDE RYP 25MG GELU |
JORF n°0226 du 28 septembre 2021 Texte n° 20
Arrêté du 24 septembre 2021 modifiant l’arrêté du 2 mars 2005 modifié pris en application de l’article L. 162-22-7 du code de la sécurité sociale et fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3157914, 3149211, 3145733, 3120578, 3139885, 3107365, 3107371, 3163168, 3194045, 3150728, 3194192, 3171140, 3165902 | Implants vasculaires |
a) A l’annexe de l’arrêté du 2 mars 2005 susvisé, les codes suivants sont radiés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3123690, 3183142, 3162217, 3121661, 3106087, 3136378, 3184839 et 3105604 | Implants vasculaires |
b) A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont radiés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 2, section 1, sous-section 2 | 3159818, 3198706 | Implant d’embolisation artérielle (pour anévrysmes, fistules artério-veineuses, tumeurs…) |
a) A l’annexe de l’arrêté du 2 mars 2005 susvisé, les codes suivants sont déplacés dans cette rubrique :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3254468, 3268772, 3238191, 3243938 | Implants vasculaires |
b) A l’annexe de l’arrêté du 2 mars 2005, la rubrique suivante est donc supprimée et les rubriques suivantes renumérotées en conséquence « sous-section 2 » et « sous-section 3 ».
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 2, section 1, sous-section 2 | Implant d’embolisation artérielle (pour anévrysmes, fistules artério-veineuses, tumeurs…) |
Le présent arrêté prend effet à compter du 1er janvier 2022.
Toutefois, par dérogation au précédent alinéa, la radiation des codes 3162217, 3121661 et 3183142 mentionnés au a de l’article 2 du présent arrêté entre en vigueur au 1er juillet 2022.
JORF n°0226 du 28 septembre 2021 Texte n° 19
Arrêté du 22 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 « Anticancéreux », les spécialités suivantes sont radiées :
| NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
| DOCETAXEL ACCORD 20 mg/ml, solution à diluer pour perfusion, flacon de 1 ml/20 mg | ACCORD | 6 589 417 4 | 9384491 | DOCETAXEL ACC20 MG/1ML FL |
| DOCETAXEL ACCORD 20 mg/ml, solution à diluer pour perfusion, flacon de 4 ml/80 mg | ACCORD | 6 111 781 9 | 9384516 | DOCETAXEL ACC80 MG/4ML FL |
| DOCETAXEL ACCORD 20 mg/ml, solution à diluer pour perfusion, flacon de 8 ml/160 mg | ACCORD | 6 840 811 5 | 9384485 | DOCETAXEL ACC160 MG/8ML FL |
| OXALIPLATINE ACCORD 5 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE | 6 722 896 1 | 9355288 | OXALIPLATIN ACC 5 MG/ML 10 ML |
| OXALIPLATINE ACCORD 5 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE | 6 722 896 1 | 9355294 | OXALIPLATIN ACC 5 MG/ML 20 ML |
| PACLITAXEL AHCL 6 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE | 6 539 466 0 | 9363299 | PACLITAXEL AHCL 6MG/ML FL5ML |
| PACLITAXEL AHCL 6 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE | 6 539 466 0 | 9363282 | PACLITAXEL AHCL 6MG/ML 16,7ML |
| PACLITAXEL AHCL 6 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE | 6 539 466 0 | 9363307 | PACLITAXEL AHCL 6MG/ML FL50ML |
| CARBOPLATINE ACCORD 10 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 906 784 1 | 9320077 | CARBOPLATINE ACC 10MG/ML 5ML |
| CARBOPLATINE ACCORD 10 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 906 784 1 | 9320054 | CARBOPLATINE ACC 10MG/ML 15ML |
| CARBOPLATINE ACCORD 10 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 906 784 1 | 9320060 | CARBOPLATINE ACC 10MG/ML 45ML |
| DOXORUBICINE ACCORD 2 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 278 337 5 | 9353734 | DOXORUBICINE ACC2MG/ML FL5ML |
| DOXORUBICINE ACCORD 2 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 278 337 5 | 9353728 | DOXORUBICINE ACC2MG/ML FL25ML |
| DOXORUBICINE ACCORD 2 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 278 337 5 | 9363247 | DOXORUBICINE ACC2MG/ML F100ML |
| ETOPOSIDE ACCORD 20 mg/mL, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 081 565 7 | 9436785 | ETOPOSIDE ACC20MG INJ FL5ML |
| ETOPOSIDE ACCORD 20 mg/mL, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 081 565 7 | 9436762 | ETOPOSIDE ACC20MG INJ FL10ML |
| ETOPOSIDE ACCORD 20 mg/mL, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 081 565 7 | 9436779 | ETOPOSIDE ACC20MG INJ FL25ML |
| ETOPOSIDE ACCORD 20 mg/mL, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 081 565 7 | 9436791 | ETOPOSIDE ACC20MG INJ FL50ML |
| FLUOROURACILE ACCORD 50 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 550 220 7 | 9334895 | FLUOROURACILE ACC 50MG FL5ML |
| FLUOROURACILE ACCORD 50 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 550 220 7 | 9334866 | FLUOROURACILE ACC 50MG FL10ML |
| FLUOROURACILE ACCORD 50 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 550 220 7 | 9334889 | FLUOROURACILE ACC 50MG FL20ML |
| FLUOROURACILE ACCORD 50 mg/ml, solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 550 220 7 | 9334872 | FLUOROURACILE ACC 50MG F100ML |
| GEMCITABINE ACCORD 200 mg, poudre pour solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 769 249 5 | 9318471 | GEMCITABINE ACC 200MG INJ FL |
| GEMCITABINE ACCORD 1 000 mg, poudre pour solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 462 291 9 | 9318465 | GEMCITABINE ACC 1000MG INJ FL |
| GEMCITABINE ACCORD 2 000 mg, poudre pour solution pour perfusion | ACCORD HEALTHCARE FRANCE | 6 407 720 5 | 9347998 | GEMCITABINE ACC 2000MG INJ FL |
| GEMCITABINE INTAS, 100 mg/ml | ACCORD HEALTHCARE FRANCE | 6 543 286 9 | 9379975 | GEMCITABINE ITA 100MG/ML 2ML |
| GEMCITABINE INTAS, 100 mg/ml | ACCORD HEALTHCARE FRANCE | 6 543 286 9 | 9379981 | GEMCITABINE ITA 100MG/ML 10ML |
| GEMCITABINE INTAS, 100 mg/ml | ACCORD HEALTHCARE FRANCE | 6 543 286 9 | 9379998 | GEMCITABINE ITA 100MG/ML 15ML |
| GEMCITABINE INTAS, 100 mg/ml | ACCORD HEALTHCARE FRANCE | 6 543 286 9 | 9380004 | GEMCITABINE ITA 100MG/ML 20ML |
| PEMETREXED ACCORD 25 mg/ml solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 692 960 7 | 9000988 | PEMETREXED ACC 25MG/ML FL4ML |
| PEMETREXED ACCORD 25 mg/ml solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 692 960 7 | 9000985 | PEMETREXED ACC 25MG/ML FL20ML |
| PEMETREXED ACCORD 25 mg/ml solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 692 960 7 | 9000986 | PEMETREXED ACC 25MG/ML FL34ML |
| PEMETREXED ACCORD 25 mg/ml solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 692 960 7 | 9000989 | PEMETREXED ACC 25MG/ML FL40ML |
| TOPOTECANE ACCORD 1mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 594 566 5 | 9386001 | TOPOTECANE ACC 1MG/ML INJ 4ML |
| VINORELBINE ACCORD 10 mg/mL, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 345 748 9 | 9437112 | VINORELBINE ACC 10MG/ML FL1ML |
| VINORELBINE ACCORD 10 mg/mL, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 345 748 9 | 9437129 | VINORELBINE ACC 10MG/ML FL5ML |
| Zercepac 150 mg poudre pour solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE | 6 092 464 2 | 9000666 | ZERCEPAC 150MG PERF FL |
| CISPLATINE ACCORD 1 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE SAS | 6 242 657 6 | 9343115 | CISPLATINE ACC 1MG/ML FL10ML |
| CISPLATINE ACCORD 1 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE SAS | 6 242 657 6 | 9343121 | CISPLATINE ACC 1MG/ML FL25ML |
| CISPLATINE ACCORD 1 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE SAS | 6 242 657 6 | 9343138 | CISPLATINE ACC 1MG/ML FL50ML |
| CISPLATINE ACCORD 1 mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE FRANCE SAS | 6 242 657 6 | 9364790 | CISPLATINE ACC 1MG/ML FL100ML |
| EPIRUBICINE ACCORD 2 mg/ml, solution injectable pour perfusion | ACCORD HEALTHCARE FRANCE SAS | 6 836 045 3 | 9343753 | EPIRUBICINE ACC 2MG/ML FL5ML |
| EPIRUBICINE ACCORD 2 mg/ml, solution injectable pour perfusion | ACCORD HEALTHCARE FRANCE SAS | 6 836 045 3 | 9343724 | EPIRUBICINE ACC 2MG/ML FL10ML |
| EPIRUBICINE ACCORD 2 mg/ml, solution injectable pour perfusion | ACCORD HEALTHCARE FRANCE SAS | 6 836 045 3 | 9343747 | EPIRUBICINE ACC 2MG/ML FL25ML |
| EPIRUBICINE ACCORD 2 mg/ml, solution injectable pour perfusion | ACCORD HEALTHCARE FRANCE SAS | 6 836 045 3 | 9343730 | EPIRUBICINE ACC 2MG/ML FL100ML |
| OXALIPLATINE ACCORD 5mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE LIMITED | 6 722 896 1 | 9365536 | OXALIPLATIN.ACC 5MG/ML 40ML |
| PACLITAXEL AHCL 6mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE LIMITED | 6 539 466 0 | 9401367 | PACLITAXEL AHCL 6MG/ML FL25ML |
| PACLITAXEL AHCL 6mg/ml, solution à diluer pour perfusion | ACCORD HEALTHCARE LIMITED | 6 539 466 0 | 9401350 | PACLITAXEL AHCL 6MG/ML F100ML |
| FLUDARABINE ACCORD 25 mg/ml, solution à diluer pour solution injectable/pour perfusion | Laboratoire ACCORD Healthcare | 6 428 163 1 | 34008 943 665 0 8 | FLUDARABINE ACC 25MG/ML FL2ML |
| IDARUBICINE ACCORD 5 mg/5 ml, solution pour perfusion | Laboratoire ACCORD Healthcare | 6 063 506 8 | 34008944 5494 6 | IDARUBICINE ACC 5MG/5ML FL |
| IDARUBICINE ACCORD 10 mg/10 ml, solution pour perfusion | Laboratoire ACCORD Healthcare | 66099467 | 34008944 5471 7 | IDARUBICINE ACC 10MG/10ML FL |
| IDARUBICINE ACCORD 20 mg/20 ml, solution pour perfusion | Laboratoire ACCORD Healthcare | 64304400 | 34008944 5488 5 | IDARUBICINE ACC 20MG/20ML FL |
| CARBOPLATINE ACTAVIS 10 mg/ml, solution pour perfusion | ACTAVIS | 6 044 661 2 | 9316236 | CARBOPLATINE ACT 10MG/ML 5ML |
| CARBOPLATINE ACTAVIS 10 mg/ml, solution pour perfusion | ACTAVIS | 6 044 661 2 | 9316207 | CARBOPLATINE ACT 10MG/ML 15ML |
| CARBOPLATINE ACTAVIS 10 mg/ml, solution pour perfusion | ACTAVIS | 6 044 661 2 | 9316213 | CARBOPLATINE ACT 10MG/ML 45ML |
| CARBOPLATINE ACTAVIS 10 mg/ml, solution pour perfusion | ACTAVIS | 6 044 661 2 | 9316242 | CARBOPLATINE ACT 10MG/ML 60ML |
| DOCETAXEL ACTAVIS 20 mg/ml | ACTAVIS | 6 547 126 3 | 9366636 | DOCETAXEL ACT 20MG/ML FL1ML |
| DOCETAXEL ACTAVIS 20 mg/ml | ACTAVIS | 6 547 126 3 | 9366642 | DOCETAXEL ACT 20MG/ML FL4ML |
| DOCETAXEL ACTAVIS 20 mg/ml | ACTAVIS | 6 547 126 3 | 9366659 | DOCETAXEL ACT 20MG/ML FL7ML |
| DOXORUBICINE ACTAVIS 2 mg/ml, poudre pour solution pour perfusion | ACTAVIS | 6 271 738 2 | 9315892 | DOXORUBICINE ACT2MG/ML FL10MG |
| DOXORUBICINE ACTAVIS 2 mg/ml, poudre pour solution pour perfusion | ACTAVIS | 6 271 738 2 | 9315900 | DOXORUBICINE ACT2MG/ML FL50MG |
| DOXORUBICINE ACTAVIS 2 mg/ml, solution pour perfusion | ACTAVIS | 6 683 771 0 | 9380613 | DOXORUBICINE ACT2MG/ML FL25ML |
| DOXORUBICINE ACTAVIS 2 mg/ml, solution pour perfusion | ACTAVIS | 6 683 771 0 | 9380636 | DOXORUBICINE ACT2MG/ML F100ML |
| GEMCITABINE ACTAVIS 38 mg/ml, poudre pour solution pour perfusion | ACTAVIS | 6 772 817 6 | 9325761 | GEMCITABINE ACT 200MG INJ FL |
| GEMCITABINE ACTAVIS 38 mg/ml, poudre pour solution pour perfusion | ACTAVIS | 6 772 817 6 | 9325755 | GEMCITABINE ACT 1 000MG INJ FL |
| GEMCITABINE ACTAVIS 38 mg/ml, poudre pour solution pour perfusion | ACTAVIS | 6 772 817 6 | 9343316 | GEMCITABINE ACT 2000MG INJ FL |
| GEMCITABINE ACTAVIS 40 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 975 352 7 | 9350931 | GEMCITABINE ACT 40MG/ML FL5ML |
| GEMCITABINE ACTAVIS 40 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 975 352 7 | 9350925 | GEMCITABINE ACT 40MG/ML F25ML |
| GEMCITABINE ACTAVIS 40 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 975 352 7 | 9350948 | GEMCITABINE ACT 40MG/ML F50ML |
| IRINOTECAN ACTAVIS 20 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 678 283 3 | 9321036 | IRINOTECAN ACT 20MG/ML INJ FL2ML |
| IRINOTECAN ACTAVIS 20 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 678 283 3 | 9321042 | IRINOTECAN ACT 20MG/ML INJ FL5ML |
| IRINOTECAN ACTAVIS 20 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 678 283 3 | 9364270 | IRINOTECAN ACT 20MG/ML FL15ML |
| IRINOTECAN ACTAVIS 20 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 678 283 3 | 9333329 | IRINOTECAN ACT 20MG/ML INJ FL25ML |
| OXALIPLATINE ACTAVIS 5 mg/ml, poudre pour solution pour perfusion | ACTAVIS | 6 577 781 9 | 9319737 | OXALIPLATIN ACT 5 MG/ML 50 MG. |
| OXALIPLATINE ACTAVIS 5 mg/ml, poudre pour solution pour perfusion | ACTAVIS | 6 577 781 9 | 9319720 | OXALIPLATIN ACT 5 MG/ML 100 MG. |
| PACLITAXEL ACTAVIS 6 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 233 478 6 | 9327932 | PACLITAXEL ACT 6 MG/ML FL 5 ML |
| PACLITAXEL ACTAVIS 6 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 233 478 6 | 9327903 | PACLITAXEL ACT 6 MG/ML 16,7 ML |
| PACLITAXEL ACTAVIS 6 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 233 478 6 | 9327926 | PACLITAXEL ACT 6 MG/ML FL 25 ML |
| PACLITAXEL ACTAVIS 6 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 233 478 6 | 9327949 | PACLITAXEL ACT 6 MG/ML FL 50 ML |
| POTACTASOL 1 mg, poudre pour solution à diluer pour perfusion | ACTAVIS | 6 803 808 9 | 9378496 | POTACTASOL 1MG INJ FL |
| POTACTASOL 4 mg, poudre pour solution à diluer pour perfusion | ACTAVIS | 6 853 100 0 | 9378504 | POTACTASOL 4MG INJ FL |
| VINORELBINE ACTAVIS 10 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 292 483 3 | 9323791 | VINORELBINE ACT 10 MG/ML FL 1 ML. |
| VINORELBINE ACTAVIS 10 mg/ml, solution à diluer pour perfusion | ACTAVIS | 6 292 483 3 | 9323816 | VINORELBINE ACT 10 MG/ML FL 5 ML |
| KANJINTI 150 mg, poudre pour solution à diluer pour perfusion | AMGEN SA | 6 152 932 4 | 9438761 | KANJINTI 150MG PERF FL |
| KANJINTI 420 mg, poudre pour solution à diluer pour perfusion | AMGEN SA | 6 119 378 8 | 9438778 | KANJINTI 420MG PERF FL |
| TRUXIMA 100 mg, solution à diluer pour perfusion | BIOGARAN | 64 237 955 | 9428165 | TRUXIMA 100 MG PERF FL 10 ML |
| TRUXIMA 500 mg, solution à diluer pour perfusion | BIOGARAN | 6 410 247 3 | 9423831 | TRUXIMA 500 MG PERF FL 50 ML |
| HERZUMA 150 mg, poudre pour solution à diluer pour perfusion | CELLTRION HEALTHCARE FRANCE | 6 242 593 7 | 9435604 | HERZUMA 150MG PERF FL |
| HERZUMA 420 mg, poudre pour solution à diluer pour perfusion. | CELLTRION HEALTHCARE FRANCE | 6 815 326 2 | 9442455 | HERZUMA 420MG PERF FL |
| EPIRUBICINE HIKMA 2 mg/ml, solution intravésicale / solution injectable | DELBERT | 6 004 234 9 | 9457209 | EPIRUBICINE HIK 2MG/ML FL5ML |
| EPIRUBICINE HIKMA 2 mg/ml, solution intravésicale / solution injectable | DELBERT | 6 004 234 9 | 9457178 | EPIRUBICINE HIK 2MG/ML FL10ML |
| EPIRUBICINE HIKMA 2 mg/ml, solution intravésicale / solution injectable | DELBERT | 6 004 234 9 | 9457190 | EPIRUBICINE HIK 2MG/ML FL25ML |
| EPIRUBICINE HIKMA 2 mg/ml, solution intravésicale / solution injectable | DELBERT | 6 004 234 9 | 9457184 | EPIRUBICINE HIK 2MG/ML FL100ML |
| GEMCITABINE HIKMA 38 mg/ml, solution à diluer pour perfusion | DELBERT | 6 369 356 4 | 9000451 | GEMCITABINE HIK 38MG/ML 5,26ML |
| GEMCITABINE HIKMA 38 mg/ml, solution à diluer pour perfusion | DELBERT | 6 369 356 4 | 9000449 | GEMCITABINE HIK 38MG/ML 26,3ML |
| GEMCITABINE HIKMA 38 mg/ml, solution à diluer pour perfusion | DELBERT | 6 369 356 4 | 9000452 | GEMCITABINE HIK 38MG/ML 52,6ML |
| PEMETREXED EG 25 mg/ml, solution à diluer pour perfusion | EG LABO – LABORATOIRES EUROGENERICS | 6 605 016 0 | 9000902 | PEMETREXED EG 25MG/ML FL4ML |
| PEMETREXED EG 25 mg/ml, solution à diluer pour perfusion | EG LABO – LABORATOIRES EUROGENERICS | 6 605 016 0 | 9000901 | PEMETREXED EG 25MG/ML FL20ML |
| PEMETREXED EG 25 mg/ml, solution à diluer pour perfusion | EG LABO – LABORATOIRES EUROGENERICS | 6 605 016 0 | 9000903 | PEMETREXED EG 25MG/ML FL40ML |
| ELDISINE 1 mg, poudre pour solution injectable | EG LABO-LABORATOIRES EUROGENERICS | 6 920 369 3 | 9120651 | ELDISINE 1MG INJ FL |
| ELDISINE 5 mg, poudre pour solution injectable | EG LABO-LABORATOIRES EUROGENERICS | 6 188 626 9 | 9268158 | ELDISINE 5MG INJ FL |
| PEMETREXED EVER PHARMA 25mg/mL, solution à diluer pour perfusion | EVER PHARMA FRANCE | 6 605 384 7 | 9000897 | PEMETREXED ERP 25MG/ML FL4ML |
| PEMETREXED EVER PHARMA 25mg/mL, solution à diluer pour perfusion | EVER PHARMA FRANCE | 6 605 384 7 | 9000896 | PEMETREXED ERP 25MG/ML FL20ML |
| PEMETREXED EVER PHARMA 25mg/mL, solution à diluer pour perfusion | EVER PHARMA FRANCE | 6 605 384 7 | 9000899 | PEMETREXED ERP 25MG/ML FL40ML |
| GEMCITABINE KABI 38 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 209 984 7 | 9417664 | GEMCITABINE KBI 38MG/ML 5,26ML |
| GEMCITABINE KABI 38 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 209 984 7 | 9417658 | GEMCITABINE KBI 38MG/ML 26,3ML |
| GEMCITABINE KABI 38 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 209 984 7 | 9417670 | GEMCITABINE KBI 38MG/ML 52,6ML |
| IRINOTECAN FRESENIUS 20 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 724 333 3 | 9334814 | IRINOTECAN FRF 20MG/ML FL2ML |
| IRINOTECAN FRESENIUS 20 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 724 333 3 | 9334820 | IRINOTECAN FRF 20MG/ML FL5ML |
| IRINOTECAN FRESENIUS 20 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 724 333 3 | 9383468 | IRINOTECAN FRF 20 MG/ML FL15 ML |
| IRINOTECAN FRESENIUS 20 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 724 333 3 | 9348006 | IRINOTECAN FRF 20MG/ML FL25ML |
| IRINOTECAN KABI 20 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 986 272 2 | 9332778 | IRINOTECAN KBI 20MG/ML FL2ML |
| IRINOTECAN KABI 20 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI | 6 986 272 2 | 9332784 | IRINOTECAN KBI 20 MG/ML FL5ML |
| CARBOPLATINE KABI 10 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 992 129 1 | 9392533 | CARBOPLATINE KBI 10 MG/ML 5 ML |
| CARBOPLATINE KABI 10 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 992 129 1 | 9392510 | CARBOPLATINE KBI 10 MG/ML 15 ML |
| CARBOPLATINE KABI 10 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 992 129 1 | 9392527 | CARBOPLATINE KBI 10 MG/ML 45 ML |
| CARBOPLATINE KABI 10 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 992 129 1 | 9392556 | CARBOPLATINE KBI 10 MG/ML 60 ML |
| DOCETAXEL KABI 20 mg/1 ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 103 871 3 | 9388891 | DOCETAXEL KBI 20 MG/1ML INJ FL |
| IRINOTECAN KABI 20 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 986 272 2 | 9345930 | IRINOTECAN KBI 20MG/ML FL15ML |
| IRINOTECAN KABI 20 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 986 272 2 | 9345947 | IRINOTECAN KBI 20MG/ML FL25ML |
| OXALIPLATINE KABI 5 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 712 772 0 | 9339272 | OXALIPLATIN.KBI 5 MG/ML 10 ML + P |
| OXALIPLATINE KABI 5 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 712 772 0 | 9339289 | OXALIPLATIN.KBI 5 MG/ML 20 ML + P |
| OXALIPLATINE KABI 5 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 712 772 0 | 9378088 | OXALIPLATIN.KBI 5 MG/ML 40 ML + P |
| PACLITAXEL KABI 6 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 117 412 2 | 9332815 | PACLITAXEL KBI 6 MG/ML FV5 ML |
| PACLITAXEL KABI 6 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 117 412 2 | 9332809 | PACLITAXEL KBI 6 MG/ML. 16,7 ML |
| PACLITAXEL KABI 6 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 117 412 2 | 9366458 | PACLITAXEL KBI 6 MG/ML FV25 ML |
| PACLITAXEL KABI 6 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 117 412 2 | 9332821 | PACLITAXEL KBI 6 MG/ML FV50 ML |
| PACLITAXEL KABI 6 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 117 412 2 | 9366441 | PACLITAXEL KBI 6MG/ML FV100ML |
| PEMETREXED FRESENIUS KABI 25 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 210 345 9 | 9000530 | PEMETREXED FRK 25MG/ML FL4ML |
| PEMETREXED FRESENIUS KABI 25 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 210 345 9 | 9000529 | PEMETREXED FRK 25MG/ML FL20ML |
| PEMETREXED FRESENIUS KABI 25 mg/ml, solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 210 345 9 | 9000531 | PEMETREXED FRK 25MG/ML FL40ML |
| PEMETREXED FRESENIUS KABI 100 mg, poudre pour solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 61 483 364 | 9419309 | PEMETREXED FRK 100MG PERF FL |
| PEMETREXED FRESENIUS KABI 500 mg, poudre pour solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 633 508 8 | 9419315 | PEMETREXED FRK 500MG PERF FL |
| DOCETAXEL KABI 80 mg/4 ml, solution à diluer pour perfusion | FRESENIUS KABI ONCOLOGY | 6 072 667 8 | 9387101 | DOCETAXEL KBI 80MG/4ML INJ FL |
| DOCETAXEL KABI 120 mg/6 ml, solution à diluer pour perfusion | FRESENIUS KABI ONCOLOGY | 6 316 601 0 | 9387070 | DOCETAXEL KBI 120MG/6ML INJ F |
| DOCETAXEL KABI 160 mg/8 ml, solution à diluer pour perfusion | FRESENIUS KABI ONCOLOGY | 6 338 054 8 | 9387087 | DOCETAXEL KBI 160MG/8ML INJ F |
| DOCETAXEL KABI 180 mg/9 ml, solution à diluer pour perfusion | FRESENIUS KABI ONCOLOGY | 6 726 468 3 | 9387093 | DOCETAXEL KBI 180MG/9ML INJ F |
| LEUSTATINE 1 mg/ml, solution pour perfusion | JANSSEN CILAG | 6 052 257 2 | 9168014 | LEUSTATINE 10 MG INJ FV 10 ML |
| CAELYX 2 mg/ml, solution à diluer pour perfusion | Schering-Plough | 6 236 236 9 | 9194460 | CAELYX 2MG/ML PERF FL10ML |
| CAELYX 2 mg/ml, solution à diluer pour perfusion | Schering-Plough | 6 236 236 9 | 9229483 | CAELYX 2MG/ML PERF FL25ML |
| AMSALYO 75 mg, poudre pour solution pour perfusion | OTL PHARMA | 6 758 134 9 | 9259113 | AMSALYO 75MG PERF FL |
| ALIMTA 100 mg, poudre pour solution à diluer pour perfusion | LILLY | 6 771 323 1 | 9311670 | ALIMTA 100MG PERF FL |
| ALIMTA 500 mg, poudre pour solution à diluer pour perfusion | LILLY | 6 732 380 8 | 9261771 | ALIMTA 500MG PERF FL |
| GEMZAR 200 mg, lyophilisat pour usage parentéral (IV) | LILLY FRANCE | 6 749 177 7 | 9182209 | GEMZAR 200MG PERF FL. |
| GEMZAR 1 000 mg, lyophilisat pour usage parentéral (IV) | LILLY FRANCE | 6 192 891 4 | 9182190 | GEMZAR 1000MG PERF FL |
| EPIRUBICINE MEDAC 2 mg/ml, solution pour perfusion | MEDAC SAS | 6 553 400 9 | 9313172 | EPIRUBICINE MDC 2MG/ML FL5ML |
| EPIRUBICINE MEDAC 2 mg/ml, solution pour perfusion | MEDAC SAS | 6 553 400 9 | 9313166 | EPIRUBICINE MDC 2MG/ML FL25ML |
| EPIRUBICINE MEDAC 2 mg/ml, solution pour perfusion | MEDAC SAS | 6 553 400 9 | 9313189 | EPIRUBICINE MDC 2MG/ML FL50ML |
| EPIRUBICINE MEDAC 2 mg/ml, solution pour perfusion | MEDAC SAS | 6 553 400 9 | 9313137 | EPIRUBICINE MDC 2MG/ML FL100ML |
| EPIRUBICINE MEDAC 2 mg/ml, solution pour perfusion | MEDAC SAS | 6 553 400 9 | 9313143 | EPIRUBICINE MDC 2MG/ML FL200ML |
| SAVENE 20 mg/ml, poudre pour solution à diluer et diluant pour solution pour perfusion. | BIOETHIC | 6 236 175 1 | 9291602 | SAVENE 20MG/ML IV FL+POC(3). |
| DACPLAT 5 mg/ml, poudre pour solution pour perfusion | DEBIOCLINIC | 6 990 124 6 | 9268129 | DACPLAT 5MG/ML PERF FL20MG |
| DACPLAT 5 mg/ml, poudre pour solution pour perfusion | DEBIOCLINIC | 6 990 124 6 | 9268135 | DACPLAT 5MG/ML PERF FL50MG |
| DACPLAT 5 mg/ml, poudre pour solution pour perfusion | DEBIOCLINIC | 6 990 124 6 | 9268112 | DACPLAT 5MG/ML PERF FL100MG |
| CARDIOXANE 500 mg, poudre pour solution pour perfusion | MEDIPHA SANTE | 6 719 950 6 | 9179029 | CARDIOXANE 500MG PERF FL |
| PROLEUKIN 18 millions UI, poudre pour solution injectable | MEDIPHA SANTE | 6 163 798 3 | 9233214 | PROLEUKIN 18 M UI INJ FL. |
| ETHYOL 50 mg/ml, poudre pour solution pour perfusion | SCHERING-PLOUGH | 6 237 112 6 | 9172607 | ETHYOL 50 MG/ML INJ FL500MG |
| DACPLAT 5 mg/ml, solution à diluer pour perfusion. | SODIA SARL | 6 933 533 9 | 9298805 | DACPLAT 5MG/ML PERF FL40ML |
| EPIRUBICINE MYLAN 2 mg/ml, solution pour perfusion | MYLAN | 6 435 451 7 | 9328481 | EPIRUBICINE MYL 2MG/ML FL50ML |
| OGIVRI 150 mg, poudre pour solution à diluer pour perfusion | MYLAN MEDICAL SAS | 6 099 049 6 | 9444069 | OGIVRI 150MG PERF FL |
| OGIVRI 420 mg, poudre pour solution à diluer pour perfusion | MYLAN MEDICAL SAS | 6 564 337 1 | 9450555 | OGIVRI 420MG PERF FL |
| PEMETREXED MYLAN 25 mg/ml, solution à diluer pour perfusion | MYLAN S.A.S | 6 154 307 8 | 9442780 | PEMETREXED MYL 25MG/ML FL20ML |
| PEMETREXED MYLAN 25 mg/ml, solution à diluer pour perfusion | MYLAN S.A.S | 6 154 307 8 | 9442805 | PEMETREXED MYL 25MG/ML FL40ML |
| PEMETREXED MYLAN 25 mg/ml, solution à diluer pour perfusion | MYLAN S.A.S | 6 154 307 8 | 9442797 | PEMETREXED MYL 25MG/ML FL4ML |
| CARBOPLATINE MYLAN 10 mg/ml, solution pour perfusion | MYLAN SAS | 6 967 134 3 | 9218628 | CARBOPLATINE MYL 10MG/ML 5ML |
| CARBOPLATINE MYLAN 10 mg/ml, solution pour perfusion | MYLAN SAS | 6 967 134 3 | 9218605 | CARBOPLATINE MYL 10MG/ML 15ML |
| CARBOPLATINE MYLAN 10 mg/ml, solution pour perfusion | MYLAN SAS | 6 967 134 3 | 9218611 | CARBOPLATINE MYL 10MG/ML 45ML |
| CARBOPLATINE MYLAN 10 mg/ml, solution pour perfusion | MYLAN SAS | 6 967 134 3 | 9241159 | CARBOPLATINE MYL 10MG/ML 60ML |
| CISPLATINE MYLAN 1 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 892 418 1 | 9217617 | CISPLATINE MYL 1MG/ML FL50ML |
| CISPLATINE MYLAN 1/ml, solution à diluer pour perfusion | MYLAN SAS | 6 892 418 1 | 9240740 | CISPLATINE MYL 1MG/ML FL100ML |
| CISPLATINE MYLAN 10 mg/10 ml, solution à diluer pour perfusion | MYLAN SAS | 6 243 237 6 | 9217592 | CISPLATINE MYL 10MG/10ML FL |
| CISPLATINE MYLAN 25 mg/25 ml, solution à diluer pour perfusion | MYLAN SAS | 6 904 241 8 | 9217600 | CISPLATINE MYL 25MG/25ML FL |
| EPIRUBICINE MYLAN 2 mg/ml, solution pour perfusion | MYLAN SAS | 6 435 451 7 | 9304492 | EPIRUBICINE MYL 2MG/ML FL5ML |
| EPIRUBICINE MYLAN 2 mg/ml, solution pour perfusion | MYLAN SAS | 6 435 451 7 | 9304457 | EPIRUBICINE MYL 2MG/ML FL10ML |
| EPIRUBICINE MYLAN 2 mg/ml, solution pour perfusion | MYLAN SAS | 6 435 451 7 | 9304486 | EPIRUBICINE MYL 2MG/ML FL25ML |
| EPIRUBICINE MYLAN 2 mg/ml, solution pour perfusion | MYLAN SAS | 6 435 451 7 | 9304463 | EPIRUBICINE MYL 2MG/ML FL100ML |
| ETOPOSIDE MYLAN 20 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 959 904 3 | 9195726 | ETOPOSIDE MYL20MG INJ FL5ML |
| ETOPOSIDE MYLAN 20 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 959 904 3 | 9224698 | ETOPOSIDE MYL20MG INJ FL10ML |
| GEMCITABINE MYLAN 40 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 228 240 7 | 9351706 | GEMCITABINE MYLAN 40MG/ML FL 5 M |
| GEMCITABINE MYLAN 40 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 228 240 7 | 9351698 | GEMCITABINE MYLAN 40MG/ML FL 25 ML |
| GEMCITABINE MYLAN 40 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 228 240 7 | 9351712 | GEMCITABINE MYLAN 40MG/ML FL 50 ML |
| IDARUBICINE MYLAN 1 mg/ml, solution pour perfusion | MYLAN SAS | 6 912 231 6 | 9371732 | IDARUBICINE MYL 1MG/ML FL5ML |
| IDARUBICINE MYLAN 1 mg/ml, solution pour perfusion | MYLAN SAS | 6 912 231 6 | 9371726 | IDARUBICINE MYL 1MG/ML FL10ML |
| IDARUBICINE MYLAN 1 mg/ml, solution pour perfusion | MYLAN SAS | 6 912 231 6 | 9371778 | IDARUBICINE MYL 1MG/ML FL20ML |
| IRINOTECAN MYLAN 20 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 030 681 3 | 9326246 | IRINOTECAN MYL 20MG/ML FL2ML |
| IRINOTECAN MYLAN 20 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 030 681 3 | 9326252 | IRINOTECAN MYL 20MG/ML FL5ML |
| IRINOTECAN MYLAN 20 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 030 681 3 | 9338249 | IRINOTECAN MYL 20MG/ML FL15ML |
| IRINOTECAN MYLAN 20 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 030 681 3 | 9338255 | IRINOTECAN MYL 20MG/ML FL25ML |
| OXALIPLATINE MYLAN 5 mg/ml, poudre pour solution pour perfusion | MYLAN SAS | 6 234 564 0 | 9297355 | OXALIPLATIN MYL5 MG/ML 50 MG. |
| OXALIPLATINE MYLAN 5 mg/ml, poudre pour solution pour perfusion | MYLAN SAS | 6 234 564 0 | 9297349 | OXALIPLATIN MYL 5MG/ML 100 MG. |
| PACLITAXEL MYLAN PHARMA 6 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 729 798 2 | 9305385 | PACLITAXEL MYP 6 MG/ML FL 5 ML |
| PACLITAXEL MYLAN PHARMA 6 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 729 798 2 | 9305379 | PACLITAXEL MYP 6 MG/ML FL 16,7 ML |
| PACLITAXEL MYLAN PHARMA 6 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 729 798 2 | 9305391 | PACLITAXEL MYP 6 MG/ML FL 50 ML |
| NOVANTRONE 10 mg/5 ml, solution injectable pour perfusion | MEDA PHARMA | 6 957 811 3 | 9122348 | NOVANTRONE 10 MG/5 ML IV FL. |
| NOVANTRONE 20 mg/10 ml, solution injectable pour perfusion | MEDA PHARMA | 6 496 217 0 | 9109827 | NOVANTRONE 20 MG/10 ML IV FL. |
| PEMETREXED OHRE PHARMA 25 mg/ml, solution à diluer pour perfusion | OHRE PHARMA | 6 675 250 9 | 9451520 | PEMETREXED OHR 25MG/ML FL20ML |
| PEMETREXED OHRE PHARMA 25 mg/ml, solution à diluer pour perfusion | OHRE PHARMA | 6 675 250 9 | 9451543 | PEMETREXED OHR 25MG/ML FL40ML |
| PEMETREXED OHRE PHARMA 25 mg/ml, solution à diluer pour perfusion | OHRE PHARMA | 6 675 250 9 | 9451537 | PEMETREXED OHR 25MG/ML FL4ML |
| ONTRUZANT 150 mg poudre pour solution à diluer pour perfusion | MSD FRANCE | 6 278 782 2 | 9438347 | ONTRUZANT 150MG PERF FL |
| ONTRUZANT 420mg, poudre pour solution à diluer pour perfusion | MSD FRANCE | 6 434 602 9 | 9447441 | ONTRUZANT 420MG PERF FL |
| HYCAMTIN 1 mg, poudre pour solution à diluer pour perfusion | GLAXOSMITHKLINE | 6 486 742 7 | 9221375 | HYCAMTIN 1MG/ML PERF FL 3 L. |
| HYCAMTIN 4 mg, poudre pour solution à diluer pour perfusion | GLAXOSMITHKLINE | 6 112 687 1 | 9187023 | HYCAMTIN 4MG PERF FL 5ML. |
| OXALIPLATINE HOSPIRA 5 mg/ml, solution à diluer pour perfusion | HOSPIRA | 6 410 117 9 | 9312770 | OXALIPLATIN.HPI 5MG/ML 10ML |
| OXALIPLATINE HOSPIRA 5 mg/ml, solution à diluer pour perfusion | HOSPIRA | 6 410 117 9 | 9312793 | OXALIPLATIN.HPI 5MG/ML 10ML +O |
| OXALIPLATINE HOSPIRA 5 mg/ml, solution à diluer pour perfusion | HOSPIRA | 6 410 117 9 | 9312787 | OXALIPLATIN.HPI 5MG/ML 20ML |
| OXALIPLATINE HOSPIRA 5 mg/ml, solution à diluer pour perfusion | HOSPIRA | 6 410 117 9 | 9312801 | OXALIPLATIN.HPI 5MG/ML 20ML +O |
| OXALIPLATINE HOSPIRA 5 mg/ml, solution à diluer pour perfusion | HOSPIRA | 6 410 117 9 | 9323845 | OXALIPLATIN.HPI 5MG/ML 40ML |
| OXALIPLATINE HOSPIRA 5 mg/ml, solution à diluer pour perfusion | HOSPIRA | 6 410 117 9 | 9323851 | OXALIPLATIN.HPI 5MG/ML 40ML +O |
| CARBOPLATINE HOSPIRA 10 mg/ml, solution injectable pour perfusion | HOSPIRA FRANCE | 6 615 079 4 | 9267957 | CARBOPLATINE HPI 10MG A/F45ML |
| CARBOPLATINE HOSPIRA 10 mg/ml, solution injectable pour perfusion | HOSPIRA FRANCE | 6 615 079 4 | 9267934 | CARBOPLATINE HPI 10MG/ML 60ML |
| CARBOPLATINE HOSPIRA 10 mg/ml, solution injectable pour perfusion | HOSPIRA FRANCE | 6 615 079 4 | 9302292 | CARBOPLATINE HPI 10MG/ML 5ML |
| CARBOPLATINE HOSPIRA 10 mg/ml, solution injectable pour perfusion | HOSPIRA FRANCE | 6 615 079 4 | 9302323 | CARBOPLATINE HPI 10MG/ML 15ML |
| CARBOPLATINE HOSPIRA 10 mg/ml, solution injectable pour perfusion | HOSPIRA FRANCE | 6 615 079 4 | 9302286 | CARBOPLATINE HPI 10MG/ML 45ML |
| CARBOPLATINE HOSPIRA 10 mg/ml, solution injectable pour perfusion | HOSPIRA FRANCE | 6 615 079 4 | 9302300 | CARBOPLATINE HPI 10MG A/F60ML |
| DOCETAXEL HOSPIRA 10 mg/ml, solution à diluer pour perfusion | HOSPIRA France | 6 965 991 4 | 9351824 | DOCETAXEL HPI 10MG/ML FL2ML |
| DOCETAXEL HOSPIRA 10 mg/ml, solution à diluer pour perfusion | HOSPIRA France | 6 965 991 4 | 9351830 | DOCETAXEL HPI 10MG/ML FL8ML |
| DOCETAXEL HOSPIRA 10 mg/ml, solution à diluer pour perfusion | HOSPIRA France | 6 965 991 4 | 9351818 | DOCETAXEL HPI 10MG/ML FL16ML |
| GEMCITABINE HOSPIRA 38 mg/ml, solution à diluer pour perfusion | HOSPIRA FRANCE | 6 245 476 4 | 9368612 | GEMCITABINE HPI 38MG/ML 5,3ML |
| GEMCITABINE HOSPIRA 38 mg/ml, solution à diluer pour perfusion | HOSPIRA FRANCE | 6 245 476 4 | 9368606 | GEMCITABINE HPI 38MG/ML 26,3ML |
| GEMCITABINE HOSPIRA 38 mg/ml, solution à diluer pour perfusion | HOSPIRA FRANCE | 6 245 476 4 | 9368629 | GEMCITABINE HPI 38MG/ML 52,6ML |
| PACLITAXEL HOSPIRA 6 mg/ml, solution à diluer pour perfusion | HOSPIRA FRANCE | 6 138 654 5 | 9308952 | PACLITAXEL HPI 6MG/ML FL5ML |
| PACLITAXEL HOSPIRA 6 mg/ml, solution à diluer pour perfusion | HOSPIRA FRANCE | 6 138 654 5 | 9308923 | PACLITAXEL HPI 6MG/ML 16,7ML |
| PACLITAXEL HOSPIRA 6 mg/ml, solution à diluer pour perfusion | HOSPIRA FRANCE | 6 138 654 5 | 9308946 | PACLITAXEL HPI 6MG/ML FL25ML |
| PACLITAXEL HOSPIRA 6 mg/ml, solution à diluer pour perfusion | HOSPIRA FRANCE | 6 138 654 5 | 9308969 | PACLITAXEL HPI 6MG/ML FL50ML |
| CAMPTO 20 mg/ml, solution à diluer pour perfusion | PFIZER | 6 012 081 2 | 9317187 | CAMPTO 20MG/ML PERF FP2ML |
| CAMPTO 20 mg/ml, solution à diluer pour perfusion | PFIZER | 6 012 081 2 | 9317193 | CAMPTO 20MG/ML PERF FP5ML |
| CAMPTO 20 mg/ml, solution à diluer pour perfusion | PFIZER | 6 012 081 2 | 9317170 | CAMPTO 20MG/ML PERF FP15ML |
| FARMORUBICINE 10 mg, poudre pour solution pour perfusion | PFIZER | 6 960 884 1 | 9145332 | FARMORUBICINE 10MG PERF FL |
| FARMORUBICINE 50 mg, poudre pour solution pour perfusion | PFIZER | 6 236 249 7 | 9145361 | FARMORUBICINE 50MG PERF FL |
| FARMORUBICINE 150 mg, poudre pour solution injectable | PFIZER | 6 091 564 3 | 9153857 | FARMORUBICINE 150MG LYOT FL |
| RUXIENCE 100 mg – solution à diluer pour perfusion | PFIZER | 6 761 374 7 | 9000391 | RUXIENCE 100MG PERF FL10ML |
| RUXIENCE 500 mg – solution à diluer pour perfusion | PFIZER | 6 621 754 9 | 9000392 | RUXIENCE 500MG PERF FL50ML |
| TRAZIMERA 420 mg, poudre pour solution à diluer pour perfusion | PFIZER | 6 591 326 5 | 9449546 | TRAZIMERA 420MG PERF FL |
| ZAVEDOS 5 mg, poudre pour solution pour perfusion | PFIZER | 6 781 544 6 | 9153403 | ZAVEDOS 5 MG LYOT INJ FL. |
| ZAVEDOS 5 mg/5 ml, solution pour perfusion | PFIZER | 6 069 226 1 | 9268543 | ZAVEDOS 5 MG INJ FP 5 ML. |
| ZAVEDOS 10 mg, poudre pour solution pour perfusion | PFIZER | 6 755 153 0 | 9153395 | ZAVEDOS 10 MG LYOT INJ FL. |
| ZAVEDOS 10 mg/10 ml, solution pour perfusion | PFIZER | 6 596 495 0 | 9268508 | ZAVEDOS 10 MG INJ FP 10 ML. |
| ZAVEDOS 10 mg/10 ml, solution pour perfusion | PFIZER | 6 596 495 0 | 9268514 | ZAVEDOS 10 MG INJ FV 10 ML. |
| ZAVEDOS 20 mg/20 ml, solution pour perfusion | PFIZER | 6 513 331 5 | 9268520 | ZAVEDOS 20 MG INJ FP 20 ML. |
| ZAVEDOS 20 mg/20 ml, solution pour perfusion | PFIZER | 6 513 331 5 | 9268537 | ZAVEDOS 20 MG INJ FV 20 ML. |
| ADRIBLASTINE 10 mg, solution injectable pour perfusion en flacon | PFIZER HOLDING FRANCE | 6 903 534 5 | 9202774 | ADRIBLASTINE 10MG/5ML FP |
| ADRIBLASTINE 10 mg/5 ml, solution injectable pour perfusion en flacon | PFIZER HOLDING FRANCE | 6 577 149 9 | 9157849 | ADRIBLASTINE 10MG LYOT FL |
| ADRIBLASTINE 50 mg/25 ml, solution injectable pour perfusion en flacon | PFIZER HOLDING FRANCE | 6 466 185 4 | 9202780 | ADRIBLASTINE 50MG/25ML FP |
| ADRIBLASTINE 50 mg, lyophilisat pour usage parentéral (perfusion) en flacon | PFIZER HOLDING FRANCE | 6 436 752 5 | 9157855 | ADRIBLASTINE 50MG LYOT FL |
| IRINOTECAN HOSPIRA 20 mg/ml, solution à diluer pour perfusion | PFIZER PFE FRANCE | 6 651 136 9 | 9333335 | IRINOTECAN HPI 20MG/ML FL2ML |
| IRINOTECAN HOSPIRA 20 mg/ml, solution à diluer pour perfusion | PFIZER PFE FRANCE | 6 651 136 9 | 9333341 | IRINOTECAN HPI 20MG/ML FL5ML |
| IRINOTECAN HOSPIRA 20 mg/ml, solution à diluer pour perfusion | PFIZER PFE FRANCE | 6 651 136 9 | 9334582 | IRINOTECAN HPI 20MG/ML FL25ML |
| NIPENT 10 mg, poudre pour solution pour injection, poudre pour solution pour perfusion | PFIZER PFE FRANCE | 6 732 254 2 | 9160509 | NIPENT 10MG INJ FL. |
| TOMUDEX 2 mg, poudre pour solution pour perfusion | PFIZER PFE FRANCE | 6 098 536 0 | 9182066 | TOMUDEX 2 MG INJ FL. |
| TOPOTECAN HOSPIRA 4 mg/4 ml, solution à diluer pour perfusion | PFIZER PFE FRANCE | 6 527 532 5 | 9355029 | TOPOTECAN HPI 4MG INJ FL4ML |
| TRAZIMERA 150 mg/15 ml, poudre pour solution à diluer pour perfusion | PFIZER PFE FRANCE | 6 446 194 6 | 9441728 | TRAZIMERA 150MG PERF FL |
| JAVLOR 25 mg/ml, solution à diluer pour perfusion | PIERRE FABRE MEDICAMENT | 6 525 609 3 | 9344853 | JAVLOR 25 MG/ML INJ FL 2 ML BG |
| JAVLOR 25 mg/ml, solution à diluer pour perfusion | PIERRE FABRE MEDICAMENT | 6 525 609 3 | 9348101 | JAVLOR 25 MG/ML INJ FL 2 ML BN |
| JAVLOR 25 mg/ml, solution à diluer pour perfusion | PIERRE FABRE MEDICAMENT | 6 525 609 3 | 9348087 | JAVLOR 25 MG/ML INJ FL 4 ML BG |
| JAVLOR 25 mg/ml, solution à diluer pour perfusion | PIERRE FABRE MEDICAMENT | 6 525 609 3 | 9348118 | JAVLOR 25 MG/ML INJ FL 4 ML BN |
| JAVLOR 25 mg/ml, solution à diluer pour perfusion | PIERRE FABRE MEDICAMENT | 6 525 609 3 | 9344847 | JAVLOR 25 MG/ML INJ FL 10 ML BG |
| JAVLOR 25 mg/ml, pour solution à diluer pour perfusion | PIERRE FABRE MEDICAMENT | 6 525 609 3 | 9348093 | JAVLOR 25 MG/ML INJ FL 10 ML BN |
| NAVELBINE 10 mg/1 ml, solution injectable en flacon | PIERRE FABRE MEDICAMENT | 6 818 442 5 | 9137172 | NAVELBINE 10 MG INJ FV 1 ML. |
| NAVELBINE 50 mg/5 ml, solution injectable en flacon | PIERRE FABRE MEDICAMENT | 6 116 899 1 | 9137189 | NAVELBINE 50 MG INJ FV 5 ML. |
| COSMEGEN 0,5 mg, poudre pour solution injectable | MERCK SHARP & DOHME CHIBRET | 6 650 763 4 | 9255724 | COSMEGEN 0,5MG INJ FL |
| PEMETREXED REDDY PHARMA 100 mg, poudre pour solution à diluer pour perfusion | REDDY PHARMA SAS | 69635532 | 9453660 | PEMETREXED RYP 100MG PERF FL |
| PEMETREXED REDDY PHARMA 500 mg, poudre pour solution à diluer pour perfusion | REDDY PHARMA SAS | 6 106 434 1 | 9453677 | PEMETREXED RYP 500MG PERF FL |
| PEMETREXED REDDY PHARMA 1000 mg, poudre pour solution à diluer pour perfusion | REDDY PHARMA SAS | 6 259 734 2 | 9000998 | PEMETREXED RYP 1000MG PERF FL |
| MABTHERA 100 mg, solution à diluer pour perfusion | ROCHE | 6 534 848 1 | 9197702 | MABTHERA 100 MG PERF FL 10 ML |
| MABTHERA 500 mg, solution à diluer pour perfusion | ROCHE | 6 200 263 8 | 9197719 | MABTHERA 500 MG PERF FL 50 ML |
| HERCEPTIN 150 mg, poudre pour solution à diluer pour perfusion | ROCHE REGISTRATION | 6 127 604 5 | 9220097 | HERCEPTIN 150 MG INJ FL. |
| HERCEPTIN 600 mg/5 ml, solution injectable | ROCHE REGISTRATION | 6 271 207 9 | 9400037 | HERCEPTIN 600 MG/5ML INJ FL |
| FLUDARABINE EBEWE 25 mg/ml, solution à diluer injectable ou pour perfusion | EBEWE PHARMA | 6 927 763 3 | 9325979 | FLUDARABINE EBW 25MG/ML FL2ML |
| OXALIPLATINE EBEWE 5 mg/ml, poudre pour solution pour perfusion | EBEWE PHARMA | 6 059 852 0 | 9301401 | OXALIPLATINE EBW 5 mg/ml 50 mg |
| OXALIPLATINE EBEWE 5 mg/ml, poudre pour solution pour perfusion | EBEWE PHARMA | 6 059 852 0 | 9301393 | OXALIPLATINE EBW 5 mg/ml 100 mg. |
| OXALIPLATINE EBEWE 5 mg/ml, poudre pour solution pour perfusion | EBEWE PHARMA | 6 059 852 0 | 9314415 | OXALIPLATINE EBW 5 MG/ML 150 MG |
| GEMCITABINE SANDOZ 40 mg/ml, solution à diluer pour perfusion. | SANDOZ | 6 396 177 0 | 9363023 | GEMCITABINE SDZ 40MG/ML FL5ML |
| GEMCITABINE SANDOZ 40 mg/ml, solution à diluer pour perfusion. | SANDOZ | 6 396 177 0 | 9363017 | GEMCITABINE SDZ 40MG/ML F25ML |
| GEMCITABINE SANDOZ 40 mg/ml, solution à diluer pour perfusion. | SANDOZ | 6 396 177 0 | 9363046 | GEMCITABINE SDZ 40MG/ML F50ML |
| PACLITAXEL EBEWE 6 mg/ml, solution à diluer pour perfusion. | SANDOZ | 6 916 163 2 | 9285406 | PACLITAXEL EBW 6 MG/ML FL 5 ML. |
| PACLITAXEL EBEWE 6 mg/ml, solution à diluer pour perfusion. | SANDOZ | 6 916 163 2 | 9285381 | PACLITAXEL EBW 6 MG/ML FL 16,7 ML. |
| PACLITAXEL EBEWE 6 mg/ml, solution à diluer pour perfusion. | SANDOZ | 6 916 163 2 | 9285398 | PACLITAXEL EBW 6 MG/ML FL 25 ML. |
| PACLITAXEL EBEWE 6 mg/ml, solution à diluer pour perfusion. | SANDOZ | 6 916 163 2 | 9285412 | PACLITAXEL EBW 6 MG/ML FL 50 ML. |
| PACLITAXEL EBEWE 6 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 916 163 2 | 9319022 | PACLITAXEL EBW 6 mg/ml fl 100ml. |
| PEMETREXED SANDOZ 25 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 825 223 9 | 9000039 | PEMETREXED SDZ 25MG/ML FL4ML |
| PEMETREXED SANDOZ 25 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 825 223 9 | 9000038 | PEMETREXED SDZ 25MG/ML FL20ML |
| PEMETREXED SANDOZ 25 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 825 223 9 | 9000040 | PEMETREXED SDZ 25MG/ML FL40ML |
| RIXATHON 100 mg, solution à diluer pour perfusion | SANDOZ | 64 018 979 | 9427450 | RIXATHON 100MG PERF FL10ML |
| RIXATHON 500 mg, solution à diluer pour perfusion | SANDOZ | 68 929 381 | 9427467 | RIXATHON 500MG PERF FL50ML |
| CERUBIDINE 20 mg, poudre pour solution pour perfusion | AVENTIS | 6 686 310 7 | 9242650 | CERUBIDINE 20MG INJ FL |
| TAXOTERE 20 mg/0,5 ml, solution à diluer et solvant pour perfusion | AVENTIS LABORATOIRE | 6 038 543 3 | 9178082 | TAXOTERE 20 MG INJ FL+FL. |
| TAXOTERE 80 mg/2 ml, solution à diluer et solvant pour perfusion | AVENTIS LABORATOIRE | 6 825 775 2 | 9178099 | TAXOTERE 80 MG INJ FL+FL. |
| CISPLATINE DAKOTA PHARM 10 mg, lyophilisat pour usage parentéral en flacon | DAKOTA PHARM | 6 453 099 7 | 9149063 | CISPLATINE DKT 10MG LYOT FL |
| CISPLATINE DAKOTA PHARM 25 mg, lyophilisat pour usage parentéral en flacon | DAKOTA PHARM | 6 203 020 3 | 9149092 | CISPLATINE DKT 25MG LYOT FL |
| CISPLATINE DAKOTA PHARM 50 mg, lyophilisat pour usage parentéral en flacon | DAKOTA PHARM | 6 374 226 0 | 9149117 | CISPLATINE DKT 50MG LYOT FL |
| FLUDARA 50 mg, poudre pour solution injectable ou perfusion | GENZYME | 6 132 412 7 | 9171341 | FLUDARA 50MG INJ FL |
| DETICENE 100 mg, poudre et solvant pour solution pour perfusion | SANOFI AVENTIS France | 6 464 512 0 | 9025711 | DETICENE 100MG INJ FL+AMP |
| OXALIPLATINE WINTHROP 5 mg/ml, solution à diluer pour perfusion | SANOFI AVENTIS FRANCE | 6 824 997 6 | 9281130 | OXALIPLATINE WTR 5 MG/ML 10 ML. |
| OXALIPLATINE WINTHROP 5 mg/ml, solution à diluer pour perfusion | SANOFI AVENTIS FRANCE | 6 824 997 6 | 9281147 | OXALIPLATINE WTR 5 MG/ML 20 ML. |
| ELOXATINE 5 mg/ml, solution à diluer pour perfusion | SANOFI SYNTHELABO FRANCE | 6 194 105 7 | 9266550 | ELOXATINE 5MG/ML PERF FL10ML |
| ELOXATINE 5 mg/ml, solution à diluer pour perfusion | SANOFI SYNTHELABO FRANCE | 6 194 105 7 | 9266567 | ELOXATINE 5MG/ML PERF FL20ML |
| FASTURTEC 1,5 mg/ml, poudre et solvant pour solution à diluer pour perfusion | SANOFI SYNTHELABO FRANCE | 6 921 115 6 | 9239116 | FASTURTEC 1,5MG/ML FL+A.1ML |
| FASTURTEC 1,5 mg/ml, poudre et solvant pour solution à diluer pour perfusion | SANOFI SYNTHELABO FRANCE | 6 921 115 6 | 9239381 | FASTURTEC 1,5MG/ML FL+A.5ML |
| MUPHORAN, poudre et solution pour usage parentéral à diluer (perfusion) | SERVIER | 6 367 518 5 | 9137580 | MUPHORAN INJ FL + AMP |
| MEPACT 4 mg, poudre pour suspension injectable par perfusion | IDM PHARMA SA | 6 078 290 1 | 9343322 | MEPACT 4 MG INJ FL |
| DOCETAXEL TEVA 20 mg/0,5 ml, solution à diluer pour perfusion | TEVA | 6 684 473 9 | 9382003 | DOCETAXEL TVC 20MG/ML FL1ML |
| DOCETAXEL TEVA 20 mg/0,5 ml, solution à diluer pour perfusion | TEVA | 6 553 803 2 | 9382026 | DOCETAXEL TVC 20MG/ML FL4ML |
| DOCETAXEL TEVA 20 mg/0,5 ml, solution à diluer et solvant pour solution pour perfusion | TEVA | 6 684 473 9 | 9382032 | DOCETAXEL TVC 20MG/ML FL7ML |
| FLUDARABINE TEVA 25 mg/ml. | TEVA CLASSICS | 6 281 888 3 | 9307800 | FLUDARABINE TVC 25MG/ML FL2ML |
| OXALIPLATINE TEVA 5 mg/ml, solution à diluer pour perfusion | TEVA CLASSICS | 6 963 453 7 | 9308863 | OXALIPLATIN. TVC 5 MG/ML 10ML. |
| OXALIPLATINE TEVA 5 mg/ml, solution à diluer pour perfusion | TEVA CLASSICS | 6 963 453 7 | 9308857 | OXALIPLATIN. TVC 5 MG/ML 20ML. |
| PACLITAXEL TEVA 6 mg/ml, solution à diluer pour perfusion | TEVA CLASSICS | 6 471 175 9 | 9278116 | PACLITAXEL TVC 6 MG/ML FL 5 ML. |
| PACLITAXEL TEVA 6 mg/ml, solution à diluer pour perfusion | TEVA CLASSICS | 6 471 175 9 | 9278091 | PACLITAXEL TVC 6 MG/ML FL 16,7 ML. |
| PACLITAXEL TEVA 6 mg/ml, solution à diluer pour perfusion | TEVA CLASSICS | 6 471 175 9 | 9308254 | PACLITAXEL TVC 6 MG/ML FL 25 ML. |
| PACLITAXEL TEVA 6 mg/ml, solution à diluer pour perfusion | TEVA CLASSICS | 6 471 175 9 | 9278122 | PACLITAXEL TVC 6 MG/ML FL 50 ML. |
| DOXORUBICINE TEVA 10 mg/5 ml, solution injectable | TEVA PHARMA | 6 362 753 2 | 9222647 | DOXORUBICINE TVC 10MG INJ FL |
| DOXORUBICINE TEVA 50 mg/25 ml, solution injectable | TEVA PHARMA | 6 983 313 3 | 9222682 | DOXORUBICINE TVC 50MG INJ FL |
| DOXORUBICINE TEVA 200 mg/100 ml, solution injectable | TEVA PHARMA | 6 946 773 2 | 9222676 | DOXORUBICINE TVC 200MG INJ FL |
| CARBOPLATINE TEVA 10 mg/ml, solution pour perfusion | TEVA PHARMA BV | 6 567 695 5 | 9210242 | CARBOPLATINE TVC 10MG/ML 5ML |
| CARBOPLATINE TEVA 10 mg/ml, solution pour perfusion | TEVA PHARMA BV | 6 567 695 5 | 9210213 | CARBOPLATINE TVC 10MG/ML 15ML |
| CARBOPLATINE TEVA 10 mg/ml, solution pour perfusion | TEVA PHARMA BV | 6 567 695 5 | 9210236 | CARBOPLATINE TVC 10MG/ML 45ML |
| CARBOPLATINE TEVA 10 mg/ml, solution pour perfusion | TEVA PHARMA BV | 6 567 695 5 | 9259691 | CARBOPLATINE TVC 10MG/ML 60ML |
| ARMISARTE 25 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 180 642 6 | 9417233 | ARMISARTE 25MG/ML PERF FL4ML |
| ARMISARTE 25 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 180 642 6 | 9417227 | ARMISARTE 25MG/ML PERF FL20ML |
| ARMISARTE 25 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 180 642 6 | 9417256 | ARMISARTE 25MG/ML PERF FL40ML |
| CISPLATINE TEVA 1 mg/1 ml, solution pour perfusion | TEVA SANTE | 6 837 755 2 | 9208245 | CISPLATINE TVC PERF FL10ML |
| CISPLATINE TEVA 1 mg/1 ml, solution pour perfusion | TEVA SANTE | 6 837 755 2 | 9208251 | CISPLATINE TVC PERF FL25ML |
| CISPLATINE TEVA 1 mg/1 ml, solution pour perfusion | TEVA SANTE | 6 837 755 2 | 9208268 | CISPLATINE TVC PERF FL50ML |
| CISPLATINE TEVA 1 mg/1 ml, solution pour perfusion | TEVA SANTE | 6 837 755 2 | 9220275 | CISPLATINE TVC PERF FL100ML |
| DOCETAXEL TEVA 20 mg/0,5 ml, solution à diluer pour perfusion | TEVA SANTE | 6 553 803 2 | 9348383 | DOCETAXEL TVC 20 MG/0,5 ML FL + FL |
| DOCETAXEL TEVA 80 mg/2 ml, solution à diluer et solvant pour perfusion | TEVA SANTE | 6 850 911 4 | 9348408 | DOCETAXEL TVC 80MG/2ML FL + FL |
| EPIRUBICINE TEVA CLASSICS 2 mg/ml, solution injectable ou pour perfusion | TEVA SANTE | 6 864 624 8 | 9337959 | EPIRUBICINE TVC.2MG/ML FL5ML |
| EPIRUBICINE TEVA CLASSICS 2 mg/ml, solution injectable ou pour perfusion | TEVA SANTE | 6 864 624 8 | 9337913 | EPIRUBICINE TVC.2MG/ML FL10ML |
| EPIRUBICINE TEVA CLASSICS 2 mg/ml, solution injectable ou pour perfusion | TEVA SANTE | 6 864 624 8 | 9337942 | EPIRUBICINE TVC.2MG/ML FL25ML |
| EPIRUBICINE TEVA CLASSICS 2 mg/ml, solution injectable ou pour perfusion | TEVA SANTE | 6 864 624 8 | 9337965 | EPIRUBICINE TVC.2MG/ML FL75ML |
| EPIRUBICINE TEVA CLASSICS 2 mg/ml, solution injectable ou pour perfusion | TEVA SANTE | 6 864 624 8 | 9337936 | EPIRUBICINE TVC.2MG/ML FL100ML |
| ETOPOSIDE TEVA 100 mg/5 ml, solution injectable pour perfusion en flacon | TEVA SANTE | 6 168 351 8 | 9186437 | ETOPOSIDE TVC 100MG INJ FL5ML |
| ETOPOSIDE TEVA 20 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 168 351 8 | 9208280 | ETOPOSIDE TVC 20MG INJ FL25ML |
| ETOPOSIDE TEVA 20 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 168 351 8 | 9208297 | ETOPOSIDE TVC 20MG INJ FL50ML |
| ETOPOSIDE TEVA 200 mg/10 ml, solution injectable pour perfusion en flacon | TEVA SANTE | 6 015 566 7 | 9186443 | ETOPOSIDE TVC 200MG INJ FL10ML |
| FLUOROURACILE TEVA 1 000 mg/20 ml, solution pour perfusion | TEVA SANTE | 6 911 842 8 | 9196163 | FLUOROURACILE TVC 1000MG 20ML |
| FLUOROURACILE TEVA 5 000 mg/100 ml, solution pour perfusion | TEVA SANTE | 6 114 647 5 | 9196200 | FLUOROURACILE TVC5000MG 100ML |
| PEMETREXED ZENTIVA 25 mg/ml, solution à diluer pour perfusion | ZENTIVA FRANCE | 6 531 904 9 | 9445761 | PEMETREXED ZEN 25MG/ML FL4ML |
| PEMETREXED ZENTIVA 25 mg/ml, solution à diluer pour perfusion | ZENTIVA FRANCE | 6 531 904 9 | 9445755 | PEMETREXED ZEN 25MG/ML FL20ML |
| PEMETREXED ZENTIVA 25 mg/ml, solution à diluer pour perfusion | ZENTIVA FRANCE | 6 531 904 9 | 9445778 | PEMETREXED ZEN 25MG/ML FL40ML |
JORF n°0226 du 28 septembre 2021 Texte n° 18
Arrêté du 22 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 Anticancéreux, les spécialités suivantes sont ajoutées :
| NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
| LENALIDOMIDE ZENTIVA 2,5 mg, gélule | ZENTIVA FRANCE | 6 373 932 1 | 9001380 | LENALIDOMIDE ZEN 2,5MG GELU |
| LENALIDOMIDE ZENTIVA 5 mg, gélule | ZENTIVA FRANCE | 6 131 046 9 | 9001383 | LENALIDOMIDE ZEN 5MG GELU |
| LENALIDOMIDE ZENTIVA 7,5 mg, gélule | ZENTIVA FRANCE | 6 503 876 0 | 9001384 | LENALIDOMIDE ZEN 7,5MG GELU |
| LENALIDOMIDE ZENTIVA 10 mg, gélule | ZENTIVA FRANCE | 6 899 965 0 | 9001378 | LENALIDOMIDE ZEN 10MG GELU |
| LENALIDOMIDE ZENTIVA 15 mg, gélule | ZENTIVA FRANCE | 6 336 522 2 | 9001379 | LENALIDOMIDE ZEN 15MG GELU |
| LENALIDOMIDE ZENTIVA 20 mg, gélule | ZENTIVA FRANCE | 6 412 574 6 | 9001381 | LENALIDOMIDE ZEN 20MG GELU |
| LENALIDOMIDE ZENTIVA 25 mg, gélule | ZENTIVA FRANCE | 6 784 889 8 | 9001377 | LENALIDOMIDE ZEN 25MG GELU |
JORF n°0226 du 28 septembre 2021 Texte n° 17
Arrêté du 22 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée pour les spécialités ci-dessous ainsi qu’il suit :
Au 5. Antifongiques, le libellé des spécialités pharmaceutiques suivantes est modifié :
| LIBELLÉS ABROGÉS | ||||
|---|---|---|---|---|
| NOM DE LA SPECIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
| MICAFUNGINE REIG JOFRE 100 mg, poudre pour solution à diluer pour perfusion | REIG JOFRE | 6 226 265 7 | 9001528 | MICAFUNGINE REI 100MG PERF FL |
| MICAFUNGINE REIG JOFRE 50 mg, poudre pour solution à diluer pour perfusion | REIG JOFRE | 6 910 537 7 | 9001529 | MICAFUNGINE REI 50MG PERF FL |
| NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
| NOM DE LA SPECIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
| MICAFUNGINE REIG JOFRE 100 mg, poudre pour solution à diluer pour perfusion | FORTE PHARMA S.A.M | 6 226 265 7 | 9001528 | MICAFUNGINE REI 100MG PERF FL |
| MICAFUNGINE REIG JOFRE 50 mg, poudre pour solution à diluer pour perfusion | FORTE PHARMA S.A.M | 6 910 537 7 | 9001529 | MICAFUNGINE REI 50MG PERF FL |
JORF n°0226 du 28 septembre 2021 Texte n° 16
Arrêté du 22 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 « Anticancéreux », les spécialités suivantes sont radiées (AMM abrogées ou archivées) :
| NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
| CARBOPLATINE CTRS 10 mg/ml solution pour perfusion | CTRS | 6 705 243 1 | 9276867 | CARBOPLATINE CTR 10MG/ML 5ML |
| CARBOPLATINE CTRS 10 mg/ml solution pour perfusion | CTRS | 6 705 243 1 | 9276844 | CARBOPLATINE CTR 10MG/ML 15ML |
| CARBOPLATINE CTRS 10 mg/ml solution pour perfusion | CTRS | 6 705 243 1 | 9276850 | CARBOPLATINE CTR 10MG/ML 45ML |
| CARBOPLATINE INTSEL CHIMOS 10 MG/ML, solution pour perfusion | INTSEL CHIMOS. | 6 272 553 2 | 9290867 | CARBOPLATINE INT 10MG/ML 5ML |
| CARBOPLATINE INTSEL CHIMOS 10 MG/ML, solution pour perfusion | INTSEL CHIMOS. | 6 272 553 2 | 9290844 | CARBOPLATINE INT 10MG/ML 15ML |
| CARBOPLATINE INTSEL CHIMOS 10 MG/ML, solution pour perfusion | INTSEL CHIMOS. | 6 272 553 2 | 9290850 | CARBOPLATINE INT 10MG/ML 45ML |
| CARBOPLATINE INTSEL CHIMOS 10 MG/ML, solution pour perfusion | INTSEL CHIMOS. | 6 272 553 2 | 9290873 | CARBOPLATINE INT 10MG/ML 60ML |
| CARBOPLATINE MEDAC 10 mg/ml, solution pour perfusion | MEDAC SAS | 6 127 974 6 | 9246547 | CARBOPLATINE MDC 10MG/ML 5ML |
| CARBOPLATINE MEDAC 10 mg/ml, solution pour perfusion | MEDAC SAS | 6 127 974 6 | 9246524 | CARBOPLATINE MDC 10MG/ML 15ML |
| CARBOPLATINE MEDAC 10 mg/ml, solution pour perfusion | MEDAC SAS | 6 127 974 6 | 9246530 | CARBOPLATINE MDC 10MG/ML 45ML |
| CARBOPLATINE MEDAC 10 mg/ml, solution pour perfusion | MEDAC SAS | 6 127 974 6 | 9246553 | CARBOPLATINE MDC 10MG/ML 60ML |
| CARBOPLATINE SANDOZ 10 mg/ml, solution pour perfusion | SANDOZ | 6 456 057 0 | 9256830 | CARBOPLATINE SDZ 10MG/ML 5ML |
| CARBOPLATINE SANDOZ 10 mg/ml, solution pour perfusion | SANDOZ | 6 456 057 0 | 9256818 | CARBOPLATINE SDZ 10MG/ML 15ML |
| CARBOPLATINE SANDOZ 10 mg/ml, solution pour perfusion | SANDOZ | 6 456 057 0 | 9256824 | CARBOPLATINE SDZ 10MG/ML 45ML |
| CARBOPLATINE SANDOZ 10 mg/ml, solution pour perfusion | SANDOZ | 6 456 057 0 | 9378125 | CARBOPLATINE SDZ 10MG/ML 60ML |
| CARBOPLATINE SANDOZ 10 mg/ml, solution pour perfusion | SANDOZ | 6 456 057 0 | 9378119 | CARBOPLATINE SDZ 10MG/ML 100ML |
| CHLORHYDRATE DE DOXORUBICINE DAKOTA PHARM 10 mg, lyophilisat pour usage parentéral en flacon | DAKOTA PHARM | 6 697 742 0 | 9145444 | DOXORUBICINE DKT 10MG INJ FL |
| CHLORHYDRATE DE DOXORUBICINE DAKOTA PHARM 50 mg, lyophilisat pour usage parentéral en flacon | DAKOTA PHARM | 6 695 926 9 | 9145450 | DOXORUBICINE DKT 50MG INJ FL |
| CISPLATINE DAKOTA PHARM 1 mg/ml, solution injectable | DAKOTA PHARM | 6 400 298 9 | 9202308 | CISPLATINE DKT 1MG/ML 10ML |
| CISPLATINE DAKOTA PHARM 1 mg/ml, solution injectable | DAKOTA PHARM | 6 400 298 9 | 9239671 | CISPLATINE DKT 1MG/ML 25ML |
| CISPLATINE DAKOTA PHARM 1 mg/ml, solution injectable | DAKOTA PHARM | 6 400 298 9 | 9202320 | CISPLATINE DKT 1MG/ML 50ML |
| CISPLATINE DAKOTA PHARM 1 mg/ml, solution injectable | DAKOTA PHARM | 6 400 298 9 | 9202314 | CISPLATINE DKT 1MG/ML 100ML |
| DACARBAZINE TEVA 100 mg, poudre pour perfusion | TEVA SANTE | 6 419 994 2 | 9360929 | DACARBAZINE TVC 100MG INJ FL |
| DAUNOXOME 2mg/ml dispersion liposomale à diluer injectable | NOVEX PHARMA | 6 717 783 7 | 9184467 | DAUNOXOME 2MG/ML INJ FL50ML |
| DOCETAXEL EBEWE 10 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 079 197 1 | 9352887 | DOCETAXEL EBW 10MG/ML FL2ML |
| DOCETAXEL EBEWE 10 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 079 197 1 | 9352893 | DOCETAXEL EBW 10MG/ML FL8ML |
| DOCETAXEL EBEWE 10 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 079 197 1 | 9367535 | DOCETAXEL EBW 10MG/ML FL16ML |
| DOCETAXEL PFIZER 10 mg/ml, solution à diluer pour perfusion | PFIZER | 6 554 040 7 | 9390899 | DOCETAXEL PFZ 10MG/ML FL 2ML |
| DOCETAXEL PFIZER 10 mg/ml, solution à diluer pour perfusion | PFIZER | 6 554 040 7 | 9390913 | DOCETAXEL PFZ 10MG/ML FL 8ML |
| DOCETAXEL PFIZER 10 mg/ml, solution à diluer pour perfusion | PFIZER | 6 554 040 7 | 9390882 | DOCETAXEL PFZ 10MG/ML FL 13ML |
| DOCETAXEL PFIZER 10 mg/ml, solution à diluer pour perfusion | PFIZER | 6 554 040 7 | 9390907 | DOCETAXEL PFZ 10MG/ML FL 20ML |
| DOCETAXEL SANDOZ 10 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 155 311 5 | 9387495 | DOCETAXEL SDZ 10MG/ML FL2ML |
| DOCETAXEL SANDOZ 10 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 155 311 5 | 9387503 | DOCETAXEL SDZ 10MG/ML FL8ML |
| DOXORUBICINE EBEWE 2 mg/ml, solution pour perfusion | EBEWE PHARMA | 6 709 741 2 | 9294664 | DOXORUBICINE EBW2MG/ML FL5ML |
| DOXORUBICINE EBEWE 2 mg/ml, solution pour perfusion | EBEWE PHARMA | 6 709 741 2 | 9294658 | DOXORUBICINE EBW2MG/ML FL25ML |
| DOXORUBICINE EBEWE 2 mg/ml, solution pour perfusion | EBEWE PHARMA | 6 709 741 2 | 9294641 | DOXORUBICINE EBW2MG/ML FL50ML |
| DOXORUBICINE EBEWE 2 mg/ml, solution pour perfusion | EBEWE PHARMA | 6 709 741 2 | 9294670 | DOXORUBICINE EBW2MG/ML FL100ML |
| DOXORUBICINE EG 2 mg/ml, solution pour perfusion | EG LABO | 6 408 083 1 | 9327151 | DOXORUBICINE EG2MG/ML FL5ML |
| DOXORUBICINE EG 2 mg/ml, solution pour perfusion | EG LABO | 6 408 083 1 | 9308188 | DOXORUBICINE EG2MG/ML FL25ML |
| EPIRUBICINE ACTAVIS 2 mg/ml, solution pour perfusion | ACTAVIS | 6 729 963 8 | 9316070 | EPIRUBICINE ACT 2MG/ML FL5ML |
| EPIRUBICINE ACTAVIS 2 mg/ml, solution pour perfusion | ACTAVIS | 6 729 963 8 | 9319708 | EPIRUBICINE ACT 2MG/ML FL10ML |
| EPIRUBICINE ACTAVIS 2 mg/ml, solution pour perfusion | ACTAVIS | 6 729 963 8 | 9316064 | EPIRUBICINE ACT 2MG/ML FL25ML |
| EPIRUBICINE ACTAVIS 2 mg/ml, solution pour perfusion | ACTAVIS | 6 729 963 8 | 9319714 | EPIRUBICINE ACT 2MG/ML FL50ML |
| EPIRUBICINE ACTAVIS 2 mg/ml, solution pour perfusion | ACTAVIS | 6 729 963 8 | 9316058 | EPIRUBICINE ACT 2MG/ML FL100ML |
| EPIRUBICINE EBEWE 2 mg/ml, solution pour perfusion | EBEWE PHARMA | 6 034 290 9 | 9293386 | EPIRUBICINE EBW 2MG/ML FL5ML |
| EPIRUBICINE EBEWE 2 mg/ml, solution pour perfusion | EBEWE PHARMA | 6 034 290 9 | 9293363 | EPIRUBICINE EBW 2MG/ML FL25ML |
| EPIRUBICINE EBEWE 2 mg/ml, solution pour perfusion | EBEWE PHARMA | 6 034 290 9 | 9293392 | EPIRUBICINE EBW 2MG/ML FL50ML |
| EPIRUBICINE EBEWE 2 mg/ml, solution pour perfusion | EBEWE PHARMA | 6 034 290 9 | 9293357 | EPIRUBICINE EBW 2MG/ML FL100ML |
| EPIRUBICINE HOSPIRA 2mg/ml, solution pour perfusion. | HOSPIRA FRANCE | 6 182 491 9 | 9284312 | EPIRUBICINE HPI 2 MG/ML FL 5ML. |
| EPIRUBICINE HOSPIRA 2mg/ml, solution pour perfusion. | HOSPIRA FRANCE | 6 182 491 9 | 9284306 | EPIRUBICINE HPI 2 MG/ML FL 25ML. |
| EPIRUBICINE HOSPIRA 2mg/ml, solution pour perfusion. | HOSPIRA FRANCE | 6 182 491 9 | 9284329 | EPIRUBICINE HPI 2 MG/ML FL 50ML. |
| EPIRUBICINE HOSPIRA 2mg/ml, solution pour perfusion. | HOSPIRA FRANCE | 6 182 491 9 | 9284335 | EPIRUBICINE HPI 2 MG/ML FL 100ML |
| EPIRUBICINE WINTHROP 2 mg/ml, solution pour perfusion | SANOFI AVENTIS FRANCE | 6 978 686 5 | 9285292 | EPIRUBICINE WTR 2MG/ML FL5ML |
| EPIRUBICINE WINTHROP 2 mg/ml, solution pour perfusion | SANOFI AVENTIS FRANCE | 6 978 686 5 | 9285257 | EPIRUBICINE WTR 2MG/ML FL10ML |
| EPIRUBICINE WINTHROP 2 mg/ml, solution pour perfusion | SANOFI AVENTIS FRANCE | 6 978 686 5 | 9285286 | EPIRUBICINE WTR 2MG/ML FL25ML |
| EPIRUBICINE WINTHROP 2 mg/ml, solution pour perfusion | SANOFI AVENTIS FRANCE | 6 978 686 5 | 9285300 | EPIRUBICINE WTR 2MG/ML FL50ML |
| EPIRUBICINE WINTHROP 2 mg/ml, solution pour perfusion | SANOFI AVENTIS FRANCE | 6 978 686 5 | 9285263 | EPIRUBICINE WTR 2MG/ML FL100ML |
| FARMORUBICINE 10 mg/5 ml, solution pour perfusion | PFIZER | 6 710 089 0 | 9202834 | FARMORUBICINE 10MG SOL FP5ML |
| FARMORUBICINE 20 mg/10 ml, solution pour perfusion | PFIZER | 6 408 643 9 | 9202840 | FARMORUBICINE 20MG SOL FP10ML |
| FARMORUBICINE 200 mg/100 ml, solution pour perfusion | PFIZER | 6 000 624 6 | 9202857 | FARMORUBICINE 200MG FP100ML |
| FARMORUBICINE 50 mg/25 ml, solution pour perfusion | PFIZER | 6 140 779 7 | 9202863 | FARMORUBICINE 50MG SOL FP25ML |
| FLUDARABINE MYLAN 25 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 987 017 4 | 9312698 | FLUDARABINE MYL 25MG/ML FL |
| FLUOROURACILE EBEWE 50 mg/ml, solution pour perfusion | EBEWE PHARMA FRANCE | 6 729 464 8 | 9340967 | FLUOROURACILE EBW 50MG FL5ML |
| FLUOROURACILE EBEWE 50 mg/ml, solution pour perfusion | EBEWE PHARMA FRANCE | 6 729 464 8 | 9340950 | FLUOROURACILE EBW 50MG FL10 ML |
| FLUOROURACILE EBEWE 50 mg/ml, solution pour perfusion | EBEWE PHARMA FRANCE | 6 729 464 8 | 9340996 | FLUOROURACILE EBW 50MG OS20ML |
| FLUOROURACILE EBEWE 50 mg/ml, solution pour perfusion | EBEWE PHARMA FRANCE | 6 729 464 8 | 9341004 | FLUOROURACILE EBW 50MG OS50ML |
| FLUOROURACILE EBEWE 50 mg/ml, solution pour perfusion | EBEWE PHARMA FRANCE | 6 729 464 8 | 9340973 | FLUOROURACILE EBW 50MG OS100ML |
| FLUOROURACILE MEDAC 50 mg/ml, solution pour perfusion | MEDAC | 6 099 242 6 | 9247239 | FLUOROURACILE MDC 50MG FL5ML |
| FLUOROURACILE MEDAC 50 mg/ml, solution pour perfusion | MEDAC | 6 099 242 6 | 9247191 | FLUOROURACILE MDC 50MG FL10ML |
| FLUOROURACILE MEDAC 50 mg/ml, solution pour perfusion | MEDAC | 6 099 242 6 | 9247222 | FLUOROURACILE MDC 50MG FL20ML |
| FLUOROURACILE MEDAC 50 mg/ml, solution pour perfusion | MEDAC | 6 099 242 6 | 9247216 | FLUOROURACILE MDC 50MG F100ML |
| FLUOROURACILE TEVA 250 mg/5 ml, solution pour perfusion | TEVA SANTE | 6 361 681 7 | 9196186 | FLUOROURACILE TVC 250MG FL5ML |
| FLUOROURACILE TEVA 500 mg/10 ml, solution pour perfusion | TEVA SANTE | 6 542 460 9 | 9196192 | FLUOROURACILE TVC500MG FL10ML |
| GEMCITABINE EBEWE PHARMA France 38 mg/ml, poudre pour solution pour perfusion | SANDOZ | 6 103 232 2 | 9324230 | GEMCITABINE EBP 200MG INJ FL |
| GEMCITABINE EBEWE PHARMA France 38 mg/ml, poudre pour solution pour perfusion | SANDOZ | 6 103 232 2 | 9324247 | GEMCITABINE EBP 1000MG INJ FL |
| GEMCITABINE EBEWE PHARMA FRANCE 38 mg/ml, poudre pour solution pour perfusion | SANDOZ | 6 103 232 2 | 9343546 | GEMCITABINE EBP 2 000MG INJ FL |
| GEMCITABINE EG 38 mg/ml, solution à diluer pour perfusion | EG LABO | 6 772 806 2 | 9343411 | GEMCITABINE EG 38MG/ML 5,26ML |
| GEMCITABINE EG 38 mg/ml, solution à diluer pour perfusion | EG LABO | 6 772 806 2 | 9343405 | GEMCITABINE EG 38MG/ML 26,3ML |
| GEMCITABINE HOSPIRA 1 g, poudre pour solution pour perfusion | HOSPIRA | 6 157 172 9 | 9309779 | GEMCITABINE HPI 1G INJ FL |
| GEMCITABINE HOSPIRA 2 g, poudre pour solution pour perfusion | HOSPIRA | 6 330 300 7 | 9309785 | GEMCITABINE HPI 2G INJ FL |
| GEMCITABINE HOSPIRA 200 mg, poudre pour solution pour perfusion | HOSPIRA | 6 005 297 3 | 9309791 | GEMCITABINE HPI 200MG INJ FL |
| GEMCITABINE MYLAN 38 mg/ml, poudre pour solution pour perfusion | MYLAN SAS | 6 273 147 8 | 9314616 | GEMCITABINE MYL 200MG INJ FL |
| GEMCITABINE MYLAN 38 mg/ml, poudre pour solution pour perfusion | MYLAN SAS | 6 273 147 8 | 9314591 | GEMCITABINE MYL 1000MG INJ FL. |
| GEMCITABINE MYLAN 38 mg/ml, poudre pour solution pour perfusion | MYLAN SAS | 6 273 147 8 | 9347863 | GEMCITABINE MYL 2000MG INJ FL. |
| GEMCITABINE TEVA 38 mg/ml, poudre pour solution pour perfusion | TEVA SANTE | 6 496 859 3 | 9329173 | GEMCITABINE TVC 200MG INJ FL |
| GEMCITABINE TEVA 38 mg/ml, poudre pour solution pour perfusion | TEVA SANTE | 6 496 859 3 | 9329196 | GEMCITABINE TVC 1 000MG INJ FL |
| GEMCITABINE TEVA 40 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 430 538 8 | 9352692 | GEMCITABINE TVC 40MG/ML FL 5 ML |
| GEMCITABINE TEVA 40 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 430 538 8 | 9352686 | GEMCITABINE TVC 40MG/ML FL 25 ML |
| GEMCITABINE TEVA 40 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 430 538 8 | 9352700 | GEMCITABINE TVC 40MG/ML FL 50 ML |
| IDARUBICINE SANDOZ 1 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 599 043 6 | 9360912 | IDARUBICINE SDZ 1 MG/ML FL5ML |
| IDARUBICINE SANDOZ 1 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 599 043 6 | 9360898 | IDARUBICINE SDZ 1 MG/ML FL10ML |
| IDARUBICINE SANDOZ 1 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 599 043 6 | 9360906 | IDARUBICINE SDZ 1 MG/ML FL20ML |
| IDARUBICINE TEVA 1 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 196 596 2 | 9365097 | IDARUBICINE TVC 1MG/ML FL5ML |
| IDARUBICINE TEVA 1 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 196 596 2 | 9365080 | IDARUBICINE TVC 1MG/ML FL10ML |
| IFOSFAMIDE EG 40 mg/ml, solution pour perfusion | EG LABO | 6 029 226 7 | 9354320 | IFOSFAMIDE EG 40MG/ML INJ 25ML |
| IFOSFAMIDE EG 40 mg/ml, solution pour perfusion | EG LABO | 6 029 226 7 | 9354337 | IFOSFAMIDE EG 40MG/ML INJ 50ML |
| IRINOTECAN EBEWE 20 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 698 127 6 | 9354923 | IRINOTECAN EBW 20 MG/ML FL2ML |
| IRINOTECAN EBEWE 20 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 698 127 6 | 9354946 | IRINOTECAN EBW 20 MG/ML 5ML |
| IRINOTECAN EBEWE 20 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 698 127 6 | 9354952 | IRINOTECAN EBW 20 MG/ML 7,5ML |
| IRINOTECAN EBEWE 20 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 698 127 6 | 9354969 | IRINOTECAN EBW 20 MG/ML 15ML |
| IRINOTECAN EBEWE 20 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 698 127 6 | 9354975 | IRINOTECAN EBW 20 MG/ML 25ML |
| IRINOTECAN EBEWE PHARMA France 20 mg/ml, solution à diluer pour perfusion (IV) | SANDOZ | 6 619 783 3 | 9330182 | IRINOTECAN EBP 20 MG/ML FL2ML |
| IRINOTECAN EBEWE PHARMA France 20 mg/ml, solution à diluer pour perfusion (IV) | SANDOZ | 6 619 783 3 | 9330199 | IRINOTECAN EBP 20 MG/ML FL5ML |
| IRINOTECAN EBEWE PHARMA France 20 mg/ml, solution à diluer pour perfusion (IV) | SANDOZ | 6 619 783 3 | 9334665 | IRINOTECAN EBP 20 MG/ML FL25ML |
| IRINOTECAN TEVA 20 mg/ml, solution à diluer pour perfusion | TEVA | 6 217 926 8 | 9324253 | IRINOTECAN TVC 20MG/ML FL2ML |
| IRINOTECAN TEVA 20 mg/ml, solution à diluer pour perfusion | TEVA | 6 217 926 8 | 9324276 | IRINOTECAN TVC 20 MG/ML INJ 5 ML. |
| IRINOTECAN TEVA 20 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 217 926 8 | 9326393 | IRINOTECAN TVC 20 MG/ML INJ25 ML |
| IRINOTECAN TEVA SANTE 20 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 272 593 8 | 9330207 | IRINOTECAN TVS 20 MG/ML INJ 2 ML |
| IRINOTECAN TEVA SANTE 20 mg/ml, solution à diluer pour perfusion | TEVA SANTE | 6 272 593 8 | 9330213 | IRINOTECAN TVS 20 MG/ML INJ 5 ML |
| OXALIPLATINE MEDAC 5 mg/ml, poudre pour solution pour perfusion | NORDIC PHARMA | 6 868 755 8 | 9302145 | OXALIPLATINE.MDC 5 MG/ML 50 MG |
| OXALIPLATINE MEDAC 5 mg/ml, poudre pour solution pour perfusion | NORDIC PHARMA | 6 868 755 8 | 9302139 | OXALIPLATINE.MDC 5 MG/ML 100 MG |
| OXALIPLATINE SANDOZ 5 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 567 716 7 | 9365186 | OXALIPLATINE.SDZ 5 MG/ML 10ML |
| OXALIPLATINE SANDOZ 5 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 567 716 7 | 9365192 | OXALIPLATINE.SDZ 5 MG/ML 20ML |
| OXALIPLATINE WINTHROP 5 mg/ml, poudre pour solution pour perfusion | SANOFI AVENTIS FRANCE | 6 969 962 0 | 9281118 | OXALIPLATINE WTR 5 MG/ML 36 ML 50MG |
| OXALIPLATINE WINTHROP 5 mg/ml, poudre pour solution pour perfusion | SANOFI AVENTIS FRANCE | 6 969 962 0 | 9281124 | OXALIPLATINE WTR 5 MG/ML 50 ML 100MG |
| TOPOTECAN KABI 1 mg/ml, poudre pour solution à diluer pour perfusion | FRESENIUS KABI FRANCE | 6 015 815 4 | 9368836 | TOPOTECAN KBI 1MG/ML INJ FL SP |
| TOPOTECAN MYLAN 1 mg/ml, solution à diluer pour perfusion | MYLAN SAS | 6 206 719 4 | 9365513 | TOPOTECAN MYL 1MG/ML INJ 4ML |
| TOPOTECAN SANDOZ 1 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 728 694 3 | 9368919 | TOPOTECAN SDZ 1MG/ML INJ 1ML |
| TOPOTECAN SANDOZ 1 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 728 694 3 | 9368925 | TOPOTECAN SDZ 1MG/ML INJ 3ML |
| TOPOTECAN SANDOZ 1 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 728 694 3 | 9368931 | TOPOTECAN SDZ 1MG/ML INJ 4ML |
| TOPOTECAN TEVA 4 mg/4 ml, solution à diluer pour perfusion | TEVA SANTE | 6 886 773 4 | 9372482 | TOPOTECAN TVC 4MG INJ FL4ML |
| VINORELBINE SANDOZ 10 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 539 652 6 | 9325956 | VINORELBINE SANDOZ 10 mg/ml, flacon de 1 ml |
| VINORELBINE SANDOZ 10 mg/ml, solution à diluer pour perfusion | SANDOZ | 6 539 652 6 | 9325962 | VINORELBINE SANDOZ 10 mg/ml, flacon de 5 ml |
| VINORELBINE TEVA 10 mg/ml, solution injectable | TEVA CLASSICS. | 6 147 738 6 | 9297094 | VINORELBINE TVC 10 MG/ML FL 1 ML |
| VINORELBINE TEVA 10 mg/ml, solution injectable | TEVA CLASSICS. | 6 147 738 6 | 9297102 | VINORELBINE TVC 10 MG/ML FL 5 ML. |
| ZANOSAR, lyophilisat pour préparation injectable | KEOCYT | 6 036 195 9 | 9123201 | ZANOSAR INJ FL. |
JORF n°0226 du 28 septembre 2021 Texte n° 15
Arrêté du 22 septembre 2021 portant modification des conditions d’inscription du ballon à élution de principe actif STELLAREX de la société SPECTRANETICS France inscrit au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0226 du 28 septembre 2021 Texte n° 13
Arrêté du 22 septembre 2021 portant radiation de spécialités pharmaceutiques de la liste des médicaments agréés à l’usage des collectivités publiques prévue à l’article L. 5123-2 du code de la santé publique
Les spécialités pharmaceutiques suivantes sont radiées de la liste des médicaments agréés à l’usage des collectivités et divers services publics. Cette radiation prend effet à l’expiration d’une période de 45 jours suivant la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 273 182 5 2 | BETMIGA 25 mg (mirabegron), comprimés à libération prolongée (B/30) (laboratoires ASTELLAS PHARMA SAS) |
34009 273 183 1 3 | BETMIGA 50 mg (mirabegron), comprimés à libération prolongée (B/30) (laboratoires ASTELLAS PHARMA SAS) |
34009 347 644 7 9 | CALCITONINE PHARMY II 100 UI/1 ml, solution injectable, 1 ml en ampoule (B/5) (laboratoires ETHYPHARM) |
34009 347 643 0 1 | CALCITONINE PHARMY II 50 UI/1 ml, solution injectable, 1 ml en ampoule (B/5) (laboratoires ETHYPHARM) |
34009 368 177 9 1 | CALCITONINE SANDOZ 50 UI/1 ml, solution injectable, 1 ml en ampoule (B/5) (laboratoires SANDOZ) |
34009 371 167 0 1 | DIACTANE 200 mg (hydrogénooxalate de naftidrofuryl), comprimés pelliculés Gé_ (B/20) (laboratoires MENARINI FRANCE) |
34009 371 170 1 2 | DIACTANE 200 mg (hydrogénooxalate de naftidrofuryl), comprimés pelliculés Gé_ (B/90) (laboratoires MENARINI FRANCE) |
34009 330 203 2 3 | MIACALCIC 50 UI/1 ml (calcitonine de saumon), solution injectable en ampoules de 1 ml (B/5) (laboratoires ESSENTIAL PHARMA) |
34009 371 175 3 1 | NAFTIDROFURYL BIOGARAN 200 mg, comprimés pelliculés (B/20) (laboratoires BIOGARAN) |
34009 371 179 9 9 | NAFTIDROFURYL BIOGARAN 200 mg, comprimés pelliculés (B/90) (laboratoires BIOGARAN) |
34009 366 646 1 6 | NAFTIDROFURYL EG 200 mg, comprimés pelliculés (B/20) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 366 648 4 5 | NAFTIDROFURYL EG 200 mg, comprimés pelliculés (B/90) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 346 442 1 4 | NAFTIDROFURYL MYLAN 100 mg, gélules (B/20) (laboratoires MYLAN SAS) |
34009 346 443 8 2 | NAFTIDROFURYL MYLAN 200 mg, comprimés pelliculés (B/20) (laboratoires MYLAN SAS) |
34009 347 491 6 2 | NAFTIDROFURYL MYLAN 200 mg, comprimés pelliculés (B/90) (laboratoires MYLAN SAS) |
34009 371 151 7 9 | NAFTIDROFURYL RANBAXY 200 mg, comprimés pelliculés (B/20) (laboratoires RANBAXY PHARMACIE GENERIQUES) |
34009 371 155 2 0 | NAFTIDROFURYL RANBAXY 200 mg, comprimés pelliculés (B/90) (laboratoires RANBAXY PHARMACIE GENERIQUES) |
34009 364 776 5 0 | NAFTIDROFURYL TEVA 200 mg, comprimés pelliculés (B/20) (laboratoires TEVA SANTE) |
34009 364 778 8 9 | NAFTIDROFURYL TEVA 200 mg, comprimés pelliculés (B/90) (laboratoires TEVA SANTE) |
34009 371 171 8 0 | NAFTIDROFURYL ZENTIVA 200 mg, comprimés pelliculés (B/20) (laboratoires ZENTIVA FRANCE) |
34009 371 174 7 0 | NAFTIDROFURYL ZENTIVA 200 mg, comprimés pelliculés (B/90) (laboratoires ZENTIVA FRANCE) |
34009 325 765 6 2 | NAFTILUX 200 mg (naftidrofuryl), gélules (B/20) (laboratoires CENTRE SPECIALITES PHARMACEUTIQUES) |
34009 332 879 3 1 | PRAXILENE 100 mg (oxalate acide de naftidrofuryl), gélules (B/20) (laboratoires MERCK SERONO) |
34009 324 264 3 0 | PRAXILENE 200 mg (oxalate acide de naftidrofuryl), comprimés pelliculés (B/20) (laboratoires MERCK SERONO) |
34009 342 055 3 8 | PRAXILENE 200 mg (oxalate acide de naftidrofuryl), comprimés pelliculés (B/90) (laboratoires MERCK SERONO) |
34009 351 974 8 1 | RELENZA 5 mg/dose (zanamivir), poudre pour inhalation en récipient unidose (B/20) avec système pour inhalation (Diskhaler) (laboratoires GLAXOSMITHKLINE) |
34009 322 857 7 8 | STRESAM (chlorhydrate d’étifoxine), gélules (B/60) (laboratoires BIOCODEX) |
JORF n°0226 du 28 septembre 2021 Texte n° 11
Arrêté du 22 septembre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
(11 inscriptions)
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 550 834 8 1 | MIDAZOLAM KALCEKS 1 mg/ml, solution injectable / pour perfusion, 5 ml en ampoule (verre) (B/10) (laboratoires MEDIPHA SANTE) |
34009 550 791 9 4 | NIMODIPINE ALTAN 10 mg/50 ml (nimodipine), solution injectable / pour perfusion, 50 ml en flacon (verre brun) (B/1) (laboratoires MEDIPHA SANTE) |
34009 301 372 5 3 | PEMETREXED SUN 100 mg, poudre pour solution à diluer pour perfusion, flacon (verre) de 10 ml (B/1) (laboratoires SUN PHARMA FRANCE) |
34009 301 372 3 9 | PEMETREXED SUN 500 mg, poudre pour solution à diluer pour perfusion, flacon (verre) de 50 ml (B/1) (laboratoires SUN PHARMA FRANCE) |
34009 550 815 4 8 | THIOTEPA RIEMSER 100 mg, poudre pour solution à diluer pour perfusion, flacon (en verre) (B/1) (laboratoires KEOCYT) |
34009 550 815 3 1 | THIOTEPA RIEMSER 15 mg, poudre pour solution à diluer pour perfusion, flacon (en verre) (B/1) (laboratoires KEOCYT) |
34009 302 243 8 0 | URAPIDIL KALCEKS 25 mg/5 ml, solution injectable / pout perfusion, 5 ml en ampoule (verre) (B/5) (laboratoires MEDIPHA SANTE) |
34009 302 243 9 7 | URAPIDIL KALCEKS 50 mg/10 ml, solution injectable / pout perfusion, 10 ml en ampoule (verre) (B/5) (laboratoires MEDIPHA SANTE) |
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour les spécialités visées ci-dessous :
– En sédation en Unité de Soins Intensifs (USI) chez l’adulte nécessitant un état de sédation pas plus profond que celui permettant une réponse à un stimulus verbal (correspondant à un score de 0 à -3 sur l’échelle de vigilance-agitation de Richmond [RASS]).
Code CIP | Présentation |
|---|---|
34009 550 832 1 4 | DEXMEDETOMIDINE KABI 100 microgrammes / ml, solution à diluer pour perfusion, 2 ml en flacon (verre) (B/10) (laboratoires FRESENIUS KABI FRANCE) |
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché excepté dans le traitement de la leucémie lymphocytaire chronique (LLC).
Code CIP | Présentation |
|---|---|
34009 302 356 0 7 | CYCLOPHOSPHAMIDE ACCORD 1 000 mg, poudre pour solution injectable / pour perfusion, poudre en flacon (verre) (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 355 9 1 | CYCLOPHOSPHAMIDE ACCORD 500 mg, poudre pour solution injectable / pour perfusion, poudre en flacon (verre) (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
(19 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit. Les spécialités précitées dont le numéro d’identification est modifié continuent à être remboursées ou prises en charge pendant une période d’un an à compter de la date de publication du présent arrêté au Journal officiel. A l’issue de ce délai, l’ancien numéro d’identification est radié.
Anciens libellés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 550 312 7 7 | ACETATE DE TERLIPRESSINE EVER PHARMA 0,2 mg/ml, solution injectable, 10 ml de solution en flacon (verre) (B/5) (Laboratoires CENTRE SPECIALITES PHARMACEUTIQUES) | 34009 550 312 7 7 | ACETATE DE TERLIPRESSINE EVER PHARMA 0,2 mg/ml, solution injectable, 10 ml de solution en flacon (verre) (B/5) (Laboratoires EVER PHARMA FRANCE) |
34009 550 312 3 9 | ACETATE DE TERLIPRESSINE EVER PHARMA 0,2 mg/ml, solution injectable, 5 ml de solution en flacon (verre) (B/5) (Laboratoires CENTRE SPECIALITES PHARMACEUTIQUES) | 34009 550 312 3 9 | ACETATE DE TERLIPRESSINE EVER PHARMA 0,2 mg/ml, solution injectable, 5 ml de solution en flacon (verre) (B/5) (Laboratoires EVER PHARMA FRANCE) |
34009 550 266 5 5 | ATOSIBAN EVER PHARMA 37,5 mg/5 mL, solution à diluer pour perfusion, flacon de 5 ml (B/1) (Laboratoires CENTRE SPECIALITES PHARMACEUTIQUES) | 34009 550 266 5 5 | ATOSIBAN EVER PHARMA 37,5 mg/5 ml, solution à diluer pour perfusion, flacon de 5 ml (B/1) (Laboratoires EVER PHARMA FRANCE) |
34009 550 266 6 2 | ATOSIBAN EVER PHARMA 6,75 mg/0,9 mL, solution injectable, flacon de 0,9 ml (B/1) (Laboratoires CENTRE SPECIALITES PHARMACEUTIQUES) | 34009 550 266 6 2 | ATOSIBAN EVER PHARMA 6,75 mg/0,9 ml, solution injectable, flacon de 0,9 ml (B/1) (Laboratoires EVER PHARMA FRANCE) |
34009 550 339 8 1 | ATOSIBAN EVER PHARMA 75 mg/10 ml, solution à diluer pour perfusion, flacon de 10 ml (B/1) (Laboratoires CENTRE SPECIALITES PHARMACEUTIQUES) | 34009 550 339 8 1 | ATOSIBAN EVER PHARMA 75 mg/10 ml, solution à diluer pour perfusion, flacon de 10 ml (B/1) (Laboratoires EVER PHARMA FRANCE) |
34009 350 774 5 5 | AUGMENTIN 1 g/200 mg Adulte (amoxicilline, acide clavulanique), poudre pour solution injectable (IV) en flacon (B/10) (Laboratoires GLAXOSMITHKLINE) | 34009 350 774 5 5 | AUGMENTIN 1 g/200 mg (amoxicilline, acide clavulanique), poudre pour solution injectable / pour perfusion (IV), poudre en flacon (verre) (B/10) (Laboratoires DELBERT) |
34009 550 572 4 6 | DEXMEDETOMIDINE EVER PHARMA 100 microgrammes/ml, solution à diluer pour perfusion, ampoules de 2 ml en verre (B/5) (Laboratoires EURODEP PHARMA) | 34009 550 572 4 6 | DEXMEDETOMIDINE EVER PHARMA 100 microgrammes/ml, solution à diluer pour perfusion, ampoules de 2 ml en verre (B/5) (Laboratoires EVER PHARMA FRANCE) |
34009 550 573 1 4 | DEXMEDETOMIDINE EVER PHARMA 100 microgrammes/ml, solution à diluer pour perfusion, flacons de 10 ml en verre (avec un volume de remplissage de 10 ml) (B/5) (Laboratoires EURODEP PHARMA) | 34009 550 573 1 4 | DEXMEDETOMIDINE EVER PHARMA 100 microgrammes/ml, solution à diluer pour perfusion, flacons de 10 ml en verre (avec un volume de remplissage de 10 ml) (B/5) (Laboratoires EVER PHARMA FRANCE) |
34009 550 572 9 1 | DEXMEDETOMIDINE EVER PHARMA 100 microgrammes/ml, solution à diluer pour perfusion, flacons de 5 ml en verre (avec un volume de remplissage de 4 ml) (B/5) (Laboratoires EURODEP PHARMA) | 34009 550 572 9 1 | DEXMEDETOMIDINE EVER PHARMA 100 microgrammes/ml, solution à diluer pour perfusion, flacons de 5 ml en verre (avec un volume de remplissage de 4 ml) (B/5) (Laboratoires EVER PHARMA FRANCE) |
34009 564 871 1 0 | MIDAZOLAM AGUETTANT 1 mg/ml, solution injectable, 5 ml en ampoule (B/10) (Laboratoires AGUETTANT) | 34009 302 330 7 8 | MIDAZOLAM AGUETTANT 1 mg/ml, solution injectable, 5 ml en ampoule (B/10) (Laboratoires AGUETTANT) |
34009 564 872 8 8 | MIDAZOLAM AGUETTANT 1 mg/ml, solution injectable, 5 ml en ampoule (B/50) (Laboratoires AGUETTANT) | 34009 302 330 8 5 | MIDAZOLAM AGUETTANT 1 mg/ml, solution injectable, 5 ml en ampoule (B/50) (Laboratoires AGUETTANT) |
34009 564 878 6 8 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 10 ml en ampoule (B/10) (Laboratoires AGUETTANT) | 34009 302 331 5 3 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 10 ml en ampoule (B/10) (Laboratoires AGUETTANT) |
34009 564 879 2 9 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 10 ml en ampoule (B/50) (Laboratoires AGUETTANT) | 34009 302 331 6 0 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 10 ml en ampoule (B/50) (Laboratoires AGUETTANT) |
34009 564 873 4 9 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 1 ml en ampoule (B/10) (Laboratoires AGUETTANT) | 34009 302 330 9 2 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 1 ml en ampoule (B/10) (Laboratoires AGUETTANT) |
34009 564 874 0 0 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 1 ml en ampoule (B/50) (Laboratoires AGUETTANT) | 34009 302 331 0 8 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 1 ml en ampoule (B/50) (Laboratoires AGUETTANT) |
34009 564 875 7 8 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 3 ml en ampoule (B/10) (Laboratoires AGUETTANT) | 34009 302 331 3 9 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 3 ml en ampoule (B/10) (Laboratoires AGUETTANT) |
34009 564 876 3 9 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 3 ml en ampoule (B/50) (Laboratoires AGUETTANT) | 34009 302 331 4 6 | MIDAZOLAM AGUETTANT 5 mg/ml, solution injectable, 3 ml en ampoule (B/50) (Laboratoires AGUETTANT) |
34009 550 087 2 9 | ORBACTIV 400 mg (oritavancine), poudre pour solution à diluer pour perfusion, flacon (verre) de 400 mg (B/3) (Laboratoires MENARINI FRANCE) | 34009 550 087 2 9 | TENKASI 400 mg (oritavancine), poudre pour solution à diluer pour perfusion, flacon (verre) de 400 mg (B/3) (Laboratoires MENARINI FRANCE) |
34009 570 518 8 4 | OXYTOCINE EVER PHARMA 5 UI/1 ml, solution injectable, ampoule en verre incolore (type I) de 1 ml (B/10) (Laboratoires CENTRE SPECIALITES PHARMACEUTIQUES) | 34009 570 518 8 4 | OXYTOCINE EVER PHARMA 5 UI/1 ml, solution injectable, ampoule en verre incolore (type I) de 1 ml (B/10) (Laboratoires EVER PHARMA FRANCE) |
JORF n°0225 du 26 septembre 2021 Texte n° 15
Décret n° 2021-1231 du 25 septembre 2021 relatif au cadre général du contrat d’amélioration de la qualité et d’efficience des soins mentionné à l’article L. 160-30-2 du code de la sécurité sociale
JORF n°0223 du 24 septembre 2021 Texte n° 20
Arrêté du 22 septembre 2021 portant changement de distributeur des prothèses totales de cheville SALTO TALARIS et INFINITY de la société TORNIER SAS inscrites au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0223 du 24 septembre 2021 Texte n° 19
Arrêté du 17 septembre 2021 modifiant l’arrêté du 17 décembre 2004 fixant la liste prévue à l’article L. 5126-4 du code de la santé publique
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 6. Autres médicaments, les spécialités suivantes sont ajoutées :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
ICATIBANT ACCORD 30 mg, solution injectable en seringue préremplie | ACCORD HEALTHCARE FRANCE | 6 616 988 7 | 9001494 | ICATIBANT ACC30MG INJ SRG3ML |
ICATIBANT REDDY PHARMA 30 mg/3 mL, solution injectable en seringue préremplie | REDDY PHARMA SAS | 6 421 214 0 | 9001459 | ICATIBANT RYP30MG/3ML INJ SRG |
JORF n°0223 du 24 septembre 2021 Texte n° 18
Arrêté du 17 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 Anticancéreux, les spécialités suivantes sont ajoutées :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
LENALIDOMIDE EG 2,5 mg, gélule | EG LABO – LABORATOIRES EUROGENERICS | 6 399 743 9 | 9001638 | LENALIDOMIDE EG 2,5MG GELU |
LENALIDOMIDE EG 5 mg, gélule | EG LABO – LABORATOIRES EUROGENERICS | 6 484 892 5 | 9001641 | LENALIDOMIDE EG 5MG GELU |
LENALIDOMIDE EG 7,5 mg, gélule | EG LABO – LABORATOIRES EUROGENERICS | 6 657 213 7 | 9001642 | LENALIDOMIDE EG 7,5MG GELU |
LENALIDOMIDE EG 10 mg, gélule | EG LABO – LABORATOIRES EUROGENERICS | 6 713 125 2 | 9001636 | LENALIDOMIDE EG 10MG GELU |
LENALIDOMIDE EG 15 mg, gélule | EG LABO – LABORATOIRES EUROGENERICS | 6 966 676 6 | 9001637 | LENALIDOMIDE EG 15MG GELU |
LENALIDOMIDE EG 20 mg, gélule | EG LABO – LABORATOIRES EUROGENERICS | 6 605 129 4 | 9001639 | LENALIDOMIDE EG 20MG GELU |
LENALIDOMIDE EG 25 mg, gélule | EG LABO – LABORATOIRES EUROGENERICS | 6 341 250 1 | 9001640 | LENALIDOMIDE EG 25MG GELU |
LENALIDOMIDE KRKA 2,5 mg gélule | KRKA FRANCE | 6 295 528 0 | 9001676 | LENALIDOMIDE KRK 2,5MG GELU |
LENALIDOMIDE KRKA 5 mg gélule | KRKA FRANCE | 6 237 795 1 | 9001680 | LENALIDOMIDE KRK 5MG GELU |
LENALIDOMIDE KRKA 7,5 mg gélule | KRKA FRANCE | 6 246 654 2 | 9001681 | LENALIDOMIDE KRK 7,5MG GELU |
LENALIDOMIDE KRKA 10 mg gélule | KRKA FRANCE | 6 760 169 1 | 9001674 | LENALIDOMIDE KRK 10MG GELU |
LENALIDOMIDE KRKA 15 mg gélule | KRKA FRANCE | 6 878 261 1 | 9001675 | LENALIDOMIDE KRK 15MG GELU |
LENALIDOMIDE KRKA 20 mg gélule | KRKA FRANCE | 6 302 481 9 | 9001677 | LENALIDOMIDE KRK 20MG GELU |
LENALIDOMIDE KRKA 25 mg gélule | KRKA FRANCE | 6 469 574 6 | 9001678 | LENALIDOMIDE KRK 25MG GELU |
LENALIDOMIDE SANDOZ 2,5 mg | SANDOZ | 6 217 158 8 | 9001668 | LENALIDOMIDE SDZ 2,5MG GELU |
LENALIDOMIDE SANDOZ 5 mg | SANDOZ | 6 731 148 5 | 9001671 | LENALIDOMIDE SDZ 5MG GELU |
LENALIDOMIDE SANDOZ 7,5 mg | SANDOZ | 6 180 701 9 | 9001672 | LENALIDOMIDE SDZ 7,5MG GELU |
LENALIDOMIDE SANDOZ 10 mg | SANDOZ | 6 967 041 2 | 9001666 | LENALIDOMIDE SDZ 10MG GELU |
LENALIDOMIDE SANDOZ 15 mg | SANDOZ | 6 615 771 4 | 9001667 | LENALIDOMIDE SDZ 15MG GELU |
LENALIDOMIDE SANDOZ 20 mg | SANDOZ | 6 019 290 4 | 9001669 | LENALIDOMIDE SDZ 20MG GELU |
LENALIDOMIDE SANDOZ 25 mg | SANDOZ | 6 399 954 3 | 9001670 | LENALIDOMIDE SDZ 25MG GELU |
JORF n°0223 du 24 septembre 2021 Texte n° 17
Arrêté du 16 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 Anticancéreux, la spécialité suivante est ajoutée :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
BORTEZOMIB KRKA 3,5 mg, poudre pour solution injectable | KRKA FRANCE | 6 925 903 7 | 9001655 | BORTEZOMIB KRK 3,5MG INJ FL |
JORF n°0223 du 24 septembre 2021 Texte n° 16
Arrêté du 16 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 2. Antirétroviraux, la spécialité suivante est ajoutée :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
RITONAVIR ARROW 100 mg, comprimé pelliculé | ARROW GENERIQUES | 6 214 841 5 | 9001602 | RITONAVIR ARW 100MG CPR |
JORF n°0222 du 23 septembre 2021 Texte n° 18
Arrêté du 22 septembre 2021 encadrant la pratique des actes associés à la pose d’implants de suspension destinés au traitement du prolapsus des organes pelviens chez la femme par voie chirurgicale haute en application des dispositions de l’article L. 1151-1 du code de santé publique
JORF n°0221 du 22 septembre 2021 Texte n° 19
Arrêté du 20 septembre 2021 portant modification des conditions d’inscription des implants d’embolisation artérielle au chapitre 1er et au chapitre 2 du titre III de la liste prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0220 du 21 septembre 2021 Texte n° 5
Arrêté du 17 septembre 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 4, section 1 | 3478179, 3424427 | Stimulateurs cardiaques |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0220 du 21 septembre 2021 Texte n° 4
Arrêté du 17 septembre 2021 portant inscription des stimulateurs cardiaques implantables simple chambre ALIZEA SR 1300 et double chambre ALIZEA DR 1600 associés au système de télésurveillance SMARTVIEW CONNECT de la société MICROPORT CRM FRANCE SAS au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0217 du 17 septembre 2021 Texte n° 28
Arrêté du 15 septembre 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une autorisation temporaire d’utilisation et pris en application de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code dans leurs rédactions antérieures au 1er juillet 2021
En application de l’article L 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code susvisés et dans le cadre de l’autorisation temporaire d’utilisation de cohorte mentionnée à l’article L. 5121-12 du code de la santé publique dont elles ont fait l’objet, les spécialités pharmaceutiques mentionnées en annexe du présent arrêté sont prises en charge par l’assurance maladie, dans l’indication mentionnée dans ladite annexe.
Les spécialités pharmaceutiques qui figurent en annexe, pour l’indication mentionnée dans ladite annexe, sont fournies, achetées, utilisées et prises en charge par les établissements de santé conformément à l’article L. 5123-2 du code de la santé publique au titre de cette autorisation temporaire d’utilisation.
Les spécialités pharmaceutiques qui figurent en annexe sont soumises à prescription hospitalière. Cette prescription est réservée aux médecins spécialistes en oncologie ou aux médecins compétents en cancérologie. Conformément à l’arrêté du 11 octobre 2019 susmentionné et en application du III de l’article R. 163-32-1 du code de la sécurité sociale susvisé, le prescripteur indique sur l’ordonnance la mention : « La prise en charge de cette spécialité intervient dans le cadre d’une prise en charge “précoce” par l’assurance maladie. A ce titre, cette prise en charge ne peut être que transitoire. »
ANNEXE
(3 spécialités)
Les spécialités suivantes sont prises en charge au titre de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code dans leurs rédactions antérieures au 1er juillet 2021 dans l’indication thérapeutique suivante :
– en association à l’ipilimumab/ nivolumab, dans le traitement des patients adultes atteints d’un cancer colorectal métastatique avec une déficience du système de réparation des mésappariements de l’ADN (dMMR) ou une instabilité microsatellitaire élevée (MSI-H), après une association antérieure de chimiothérapie à base de fluoropyrimidine, n’ayant pas reçu un traitement antérieur par immunothérapie et présentant un score ECOG de 0 ou 1.
Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
Nivolumab | OPDIVO 10 mg/mL solution à diluer pour perfusion | 3400894389798 | OPDIVO 10MG/ML PERF FL24ML | Bristol-Myers Squibb |
Nivolumab | OPDIVO 10 mg/mL solution à diluer pour perfusion | 3400894094692 | OPDIVO 10MG/ML PERF FL4ML | Bristol-Myers Squibb |
Ipilimumab | YERVOY 5 mg/mL solution à diluer pour perfusion | 3400893740507 | YERVOY 5MG/ML PERF FL10ML | Bristol-Myers Squibb |
JORF n°0217 du 17 septembre 2021 Texte n° 26
Arrêté du 13 septembre 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La prise en charge en sus des prestations d’hospitalisation des spécialités ci-dessous est étendue à l’indication suivante :
– en association au paclitaxel, est indiqué chez les patientes adultes atteintes d’un cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif, en rechute, résistant aux sels de platine, qui n’ont pas reçu plus de deux protocoles antérieurs de chimiothérapie et qui n’ont pas été préalablement traitées par du bevacizumab ou d’autres inhibiteurs du VEGF ou d’autres agents ciblant le récepteur du VEGF.
Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
BEVACIZUMAB | MVASI 25 mg/ml, solution à diluer pour perfusion | 3400890000994 | MVASI 25MG/ML PERF FL16ML | AMGEN SAS |
BEVACIZUMAB | MVASI 25 mg/ml, solution à diluer pour perfusion | 3400890001007 | MVASI 25MG/ML PERF FL4ML | AMGEN SAS |
JORF n°0217 du 17 septembre 2021 – Texte n°23
Arrêté du 8 septembre 2021 relatif au management de la qualité du circuit des dispositifs médicaux implantables dans les établissements de santé et les installations de chirurgie esthétique
RETEX DMI
JORF n°0217 du 17 septembre 2021 Texte n° 22
Arrêté du 8 septembre 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La spécialité suivante est inscrite sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
La seule indication thérapeutique ouvrant droit à la prise en charge en sus par l’assurance maladie est, pour la spécialité visée ci-dessous :
– pour les patients âgés de 18 ans et plus, atteints de porphyries hépatiques aiguës (PHA) et ayant une maladie active caractérisée par au moins 2 crises de porphyrie nécessitant une hospitalisation, une visite médicale urgente ou un traitement par hémine IV à domicile, au cours des 6 mois précédents
Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
givosiran | GIVLAARI 189 mg/1 mL, solution injectable | 3400890000413 | GIVLAARI 189MG/ML INJ FL1ML | ALNYLAM FRANCE |
JORF n°0217 du 17 septembre 2021 Texte n° 21
Arrêté du 8 septembre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
(1 inscription)
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
L’indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie, pour la spécialité visée ci-dessous, concerne uniquement les patients âgés de plus de 18 ans, atteints de porphyries hépatiques aiguës (PHA) et ayant une maladie active caractérisée par au moins 2 crises de porphyrie nécessitant une hospitalisation, une visite médicale urgente ou un traitement par hémine IV à domicile, au cours des 6 mois précédents.
Code CIP | Présentation |
|---|---|
34009 302 163 1 6 | GIVLAARI 189 mg/1 ml (givosiran), solution injectable, 1 ml en flacon (B/1) (laboratoires ALNYLAM FRANCE) |
(1 modification)
Le libellé de la spécialité pharmaceutique suivante est modifié comme suit. La spécialité précitée dont le numéro d’identification est modifié continue à être remboursée ou prise en charge pendant une période d’un an à compter de la date de publication du présent arrêté au Journal officiel. A l’issue de ce délai, l’ancien numéro d’identification est radié.
Ancien libellé | Nouveau libellé | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 550 722 7 0 | GIVLAARI 189 mg/1 ml (givosiran), solution injectable, 1 ml en flacon (B/1) (laboratoires ALNYLAM FRANCE) | 34009 302 163 1 6 | GIVLAARI 189 mg/1 ml (givosiran), solution injectable, 1 ml en flacon (B/1) (laboratoires ALNYLAM FRANCE) |
JORF n°0217 du 17 septembre 2021 -Texte n° 20
Arrêté du 8 septembre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique BLENREP 100 mg est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics. L’inscription prend effet deux semaines suivant la date de publication du présent arrêté.
L’indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est:
en monothérapie pour le traitement des patients adultes atteints de myélome multiple, ayant reçu au moins 4 traitements antérieurs et dont la maladie est réfractaire à au moins un inhibiteur du protéasome, un agent immunomodulateur et un anticorps monoclonal anti-CD38, et dont la maladie a progressé lors du dernier traitement.
| Code CIP | Présentation |
|---|---|
| 34009 550 756 2 2 | BLENREP 100 mg (belantamab mafodotin), poudre pour solution à diluer pour perfusion, voie intraveineuse, flacon (verre) (B/1) (laboratoires GLAXOSMITHKLINE) |
JORF n°0217 du 17 septembre 2021 Texte n° 19
Arrêté du 7 septembre 2021 introduisant une condition de prescription pour la prise en charge d’une spécialité pharmaceutique
L’inscription de la spécialité ENERZAIR BREEZHALER® sur la liste des spécialités remboursables aux assurés sociaux et sur la liste des médicaments agréés à l’usage des collectivités publiques, au titre des deux arrêtés du 12 juillet 2021 susvisés, est assortie d’une condition tenant à ce que la prescription initiale du médicament soit réalisée en concertation avec un médecin pneumologue.
Le présent arrêté prend effet à compter du quatrième jour suivant la date de sa publication au Journal officiel de la République française.
JORF n°0217 du 17 septembre 2021 -Texte n° 18
Arrêté du 26 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue dans l’indication suivante :
– en association au paclitaxel, est indiqué chez les patientes adultes atteintes d’un cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif, en rechute, résistant aux sels de platine, qui n’ont pas reçu plus de deux protocoles antérieurs de chimiothérapie et qui n’ont pas été préalablement traitées par du bevacizumab ou d’autres inhibiteurs du VEGF ou d’autres agents ciblant le récepteur du VEGF.
| Code CIP | Présentation |
|---|---|
| 34009 550 662 0 0 | MVASI 25 mg/ml (bévacizumab), solution à diluer pour perfusion, flacon (verre) de 16 ml (B/1) (laboratoires AMGEN SAS) |
| 34009 550 661 9 4 | MVASI 25 mg/ml (bévacizumab), solution à diluer pour perfusion, flacon (verre) de 4 ml (B/1) (laboratoires AMGEN SAS) |
JORF n°0211 du 10 septembre 2021 Texte n° 23
Arrêté du 7 septembre 2021 modifiant l’arrêté du 22 février 1990 portant exonération à la réglementation des substances vénéneuses destinées à la médecine humaine
N’est pas soumise à la réglementation des substances vénéneuses la spécialité pharmaceutique suivante, disposant d’une autorisation de mise sur le marché délivrée par la Commission européenne et dont les substances actives sont la lidocaïne et la prilocaïne, dosées respectivement à 150 mg/ml et 50 mg/ml présentée sous forme d’un spray cutané en solution : FORTACIN 150 mg/ml spray cutané, solution.
JORF n°0211 du 10 septembre 2021 Texte n° 22
Arrêté du 2 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée pour les spécialités ci-dessous ainsi qu’il suit :
1) Au 6 « Autres médicaments », le libellé des spécialités pharmaceutiques suivantes est modifié :
LIBELLÉS ABROGÉS | ||||
|---|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
SYNAGIS 100 mg/ml, solution injectable | ABBVIE | 6 781 086 9 | 9420962 | SYNAGIS 100MG/ML INJ FL0,5ML |
SYNAGIS 100 mg/ml, solution injectable | ABBVIE | 6 781 086 9 | 9420979 | SYNAGIS 100MG/ML INJ FL1ML |
NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
SYNAGIS 50 mg/0,5 ml, solution injectable | ASTRAZENECA | 6 893 253 4 | 9420962 | SYNAGIS 50MG INJ FL0,5ML 1 |
SYNAGIS 100 mg/ml, solution injectable | ASTRAZENECA | 6 781 086 9 | 9420979 | SYNAGIS 100MG/ML INJ FL1ML |
2) Au 6 « Autres medicaments », les spécialités suivantes sont radiées :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
SYNAGIS 50 mg, poudre et solvant pour solution injectable | ABBVIE | 6 386 422 5 | 9213766 | SYNAGIS 50MG INJ FL+AMP. |
SYNAGIS 100 mg, poudre et solvant pour solution injectable | ABBVIE | 6 181 793 5 | 9213743 | SYNAGIS 100MG INJ FL+AMP. |
JORF n°0211 du 10 septembre 2021 Texte n° 21
Arrêté du 2 septembre 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 Anticancéreux, les spécialités suivantes sont ajoutées :
NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
LENALIDOMIDE MYLAN 2,5 mg, gélule | MYLAN S.A.S | 6 040 118 6 | 9001406 | LENALIDOMIDE MYL 2,5MG GELU |
LENALIDOMIDE MYLAN 5 mg, gélule | MYLAN S.A.S | 66903224 | 9001409 | LENALIDOMIDE MYL 5MG GELU |
LENALIDOMIDE MYLAN 7,5 mg, gélule | MYLAN S.A.S | 67762538 | 9001410 | LENALIDOMIDE MYL 7,5MG GELU |
LENALIDOMIDE MYLAN 10 mg, gélule | MYLAN S.A.S | 64174946 | 9001404 | LENALIDOMIDE MYL 10MG GELU |
LENALIDOMIDE MYLAN 15 mg, gélule | MYLAN S.A.S | 69436263 | 9001405 | LENALIDOMIDE MYL 15MG GELU |
LENALIDOMIDE MYLAN 20 mg, gélule | MYLAN S.A.S | 60535915 | 9001407 | LENALIDOMIDE MYL 20MG GELU |
LENALIDOMIDE MYLAN 25 mg, gélule | MYLAN S.A.S | 69256226 | 9001408 | LENALIDOMIDE MYL 25MG GELU |
LENALIDOMIDE TEVA 2,5 mg, gélule | TEVA SANTE | 6 324 730 2 | 9001603 | LENALIDOMIDE TVC 2,5MG GEL |
LENALIDOMIDE TEVA 5 mg, gélule | TEVA SANTE | 6 330 222 9 | 9001605 | LENALIDOMIDE TVC 5MG GELU |
LENALIDOMIDE TEVA 7,5 mg, gélule | TEVA SANTE | 6 169 576 2 | 9001606 | LENALIDOMIDE TVC 7,5MG GEL |
LENALIDOMIDE TEVA 10 mg, gélule | TEVA SANTE | 6 262 559 2 | 9001607 | LENALIDOMIDE TVC 10MG GELU |
LENALIDOMIDE TEVA 15 mg, gélule | TEVA SANTE | 6 738 899 4 | 9001608 | LENALIDOMIDE TVC 15MG GELU |
LENALIDOMIDE TEVA 20 mg, gélule | TEVA SANTE | 6 505 582 0 | 9001609 | LENALIDOMIDE TVC 20MG GELU |
LENALIDOMIDE TEVA 25 mg, gélule | TEVA SANTE | 6 076 649 8 | 9001611 | LENALIDOMIDE TVC 25MG GELU |
JORF n°0209 du 8 septembre 2021 Texte n° 15
Arrêté du 6 septembre 2021 portant modification des conditions d’inscription des systèmes d’implants cochléaires des sociétés Advanced Bionics, Cochlear France, MED-EL Elektromedizinische Geräte GmbH et Neurelec inscrits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0208 du 7 septembre 2021 Texte n° 13
Arrêté du 1er septembre 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
a) A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont radiés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 3, sous-section 4 | 3191348, 3166801, 3159497, 3199456, 3132920, 3135999 | Substituts osseux |
b) A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont radiés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 2, section 2, sous-section 1 | 3277446, 3203689, 3287396, 3295591, 3228778, 3251056, 3296343, 3216670, 3219561, 3267241, 3230924, 3271350, 3218395, 3226012, 3247563, 3214569, 3296580, 3240673, 3263310, 3206676, 3200627, 3220920, 3263266, 3223002, 3240182, 3234371, 3283613, 3217993, 3240012, 3228360, 3295540, 3210206, 3276493, 3210873, 3204772, 3236536, 3273804, 3292078, 3206860, 3235844, 3263243, 3224444, 3250890, 3239954, 3244613, 3242703, 3292747, 3266342, 3257550, 3277854, 3279155, 3259098, 3290317, 3235270, 3239523, 3284363, 3221919, 3281287, 3235376, 3290211, 3227336, 3276694, 3208913, 3290843, 3223143, 3204460, 3236163, 3200395, 3214658, 3258503, 3288310, 3236849, 3205895, 3285983, 3280106, 3261876, 3294350, 3213044, 3245854, 3283866, 3266307, 3208617, 3257047, 3272093, 3212145, 3205323, 3220179, 3222250, 3271521, 3279600, 3224310, 3253300, 3244731, 3216195, 3219087, 3245328, 3297740, 3216723, 3233331, 3231496, 3270987, 3250654, 3226348, 3292598, 3295355, 3263237, 3204803, 3274420, 3222209, 3212895, 3233420, 3222913, 3226609, 3277802, 3202922, 3230723, 3299531, 3209746, 3284038, 3226466, 3221150, 3209485, 3295310, 3246055, 3235703, 3229855 | Implants ou substituts osseux |
c) A l’annexe de l’arrêté du 2 mars 2005, le code suivant est radié :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 2, section 2, sous-section 2 | 3290889 | Obturateurs à ciment centro-médullaire pour pose d’implants articulaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0208 du 7 septembre 2021 Texte n° 12
Arrêté du 1er septembre 2021 portant radiation de certains substituts osseux inscrits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0204 du 2 septembre 2021 Texte n° 40
Arrêté du 30 août 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une recommandation temporaire d’utilisation et pris en application de l’article L. 162-17-2-1 du code de la sécurité sociale dans sa rédaction en vigueur avant le 1er juillet 2021
En application de l’article L. 162-17-2-1 du code de la sécurité sociale dans sa rédaction en vigueur avant le 1er juillet 2021 et dans le cadre de la recommandation temporaire d’utilisation dont elle fait l’objet, les spécialités pharmaceutiques mentionnées en annexe du présent arrêté sont prises en charge, pour une durée de trois ans, dans l’indication mentionnée dans ladite annexe.
Les spécialités pharmaceutiques disposant d’une recommandation temporaire d’utilisation inscrites sur la liste prévue à l’article L. 5126-6 du code de la santé publique qui figurent en annexe sont prises en charge par l’assurance maladie conformément à l’article L. 162-17, deuxième alinéa, du code de la sécurité sociale. Cette annexe précise la seule indication thérapeutique ouvrant droit à la prise en charge ou au remboursement de ces spécialités sur ladite liste et à la suppression de la participation de l’assuré en application de l’article R. 160-8 susvisé.
La prescription des spécialités pharmaceutiques, dans l’indication mentionnée en annexe du présent arrêté, est soumise à prescription hospitalière et réservée aux spécialistes en oncologie ou en cancérologie.
L’entreprise exploitant les spécialités pharmaceutiques figurant en annexe est tenue de mettre en place le suivi des patients selon les modalités prévues dans le protocole mentionné à l’article R. 5121-76-1 du code de la santé publique dans sa rédaction en vigueur avant le 1er juillet 2021.
ANNEXE
Libellé des spécialités pharmaceutiques prises en charge et laboratoire exploitant | Indication objet de la recommandation temporaire d’utilisation |
|---|---|
XALKORI 200 mg, gélule (Crizotinib) – Laboratoire PFIZER | Traitement des patients adultes atteints d’un cancer bronchique non à petites cellules localement avancé ou métastatique présentant une mutation de l’exon 14 de c-met, après au moins une ligne de traitement à base de doublet de platine associé ou non à une immunothérapie |
XALKORI 250 mg, gélule (Crizotinib) – Laboratoire PFIZER |
JORF n°0204 du 2 septembre 2021 Texte n° 36
Arrêté du 24 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
1. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– chez les adultes avec hypercholestérolémie (familiale hétérozygote, homozygote ou non familiale) ou une dyslipidémie mixte non contrôlée par un traitement bien conduit par une statine en monothérapie lorsque l’utilisation d’une association est appropriée ;
– chez les patients recevant déjà de l’atorvastatine et de l’ézétimibe aux mêmes doses, dans le cadre d’un traitement de substitution.
Code CIP | Présentation |
|---|---|
34009 490 046 8 3 | LIPTRUZET 10 mg/20 mg (ézétimibe, atorvastatine), comprimés pelliculés (B/30) (laboratoires BB FARMA) |
34009 490 046 9 0 | LIPTRUZET 10 mg/20 mg (ézétimibe, atorvastatine), comprimés pelliculés (B/90) (laboratoires BB FARMA) |
34009 490 047 0 6 | LIPTRUZET 10 mg/40 mg (ézétimibe, atorvastatine), comprimés pelliculés (B/30) (laboratoires BB FARMA) |
34009 490 047 1 3 | LIPTRUZET 10 mg/40 mg (ézétimibe, atorvastatine), comprimés pelliculés (B/90) (laboratoires BB FARMA) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 268 5 8 | KESIMPTA 20 mg (ofatumumab), solution injectable, 0,4 ml (50 mg/ml) en seringue préremplie (B/1) (laboratoires NOVARTIS PHARMA SAS) |
34009 302 269 7 1 | KESIMPTA 20 mg (ofatumumab), solution injectable, 0,4 ml (50 mg/ml) en stylo prérempli (B/1) (laboratoires NOVARTIS PHARMA SAS) |
34009 301 800 0 6 | LATAZED 50 microgrammes/ml (latanoprost), collyre en solution, 2,5 ml en flacon multidose polyéthylène haute densité (PEHD) avec pompe polypropylène polyéthylène haute densité (PEHD) polyéthylène basse densité (PEBD) (B/1) (laboratoires HORUS PHARMA) |
34009 301 800 1 3 | LATAZED 50 microgrammes/ml (latanoprost), collyre en solution, 2,5 ml en flacon multidose polyéthylène haute densité (PEHD) avec pompe polypropylène polyéthylène haute densité (PEHD) polyéthylène basse densité (PEBD) (B/3) (laboratoires HORUS PHARMA) |
34009 302 078 0 2 | TAVLESSE 100 mg (fostamatinib), comprimés pelliculés en flacon (B/60) (laboratoires GRIFOLS FRANCE) |
34009 302 078 1 9 | TAVLESSE 150 mg (fostamatinib), comprimés pelliculés en flacon (B/60) (laboratoires GRIFOLS FRANCE) |
JORF n°0204 du 2 septembre 2021 Texte n° 34
Arrêté du 24 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue aux indications suivantes :
– traitement de la spondylarthrite ankylosante active chez les patients adultes qui ont présenté une réponse inadéquate au traitement conventionnel ;
– traitement du rhumatisme psoriasique (RP) actif chez les patients adultes qui ont présenté une réponse inadéquate ou une intolérance à un ou plusieurs traitements de fond (DMARD). RINVOQ (upadacitinib) peut être utilisé en monothérapie ou en association au méthotrexate.
Code CIP | Présentation |
|---|---|
34009 301 939 8 3 | RINVOQ 15MG (upadacitinib), comprimés à libération prolongée (B/28) (laboratoires ABBVIE) |
JORF n°0204 du 2 septembre 2021 Texte n° 32
Arrêté du 20 août 2021 modifiant l’arrêté du 17 décembre 2004 fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 Anticancéreux, la spécialité suivante est ajoutée :
| NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
| BORTEZOMIB SUN 3,5 mg, poudre pour solution injectable | SUN PHARMA FRANCE | 6 118 093 3 | 9001520 | BORTEZOMIB SUN 3,5MG INJ FL |
JORF n°0204 du 2 septembre 2021 Texte n° 31
Arrêté du 20 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
L’annexe de l’arrêté du 28 juillet 2021 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux (Journal officiel du 6 août 2021, NOR : SSAS2119439A, texte 24) est remplacée par :
« (2 inscriptions)
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour les spécialités visées ci-dessous :
– traitement continu de la bronchopneumopathie chronique obstructive (BPCO) sévère chez les adultes non traités de façon satisfaisante par l’association d’un corticostéroïde inhalé et d’un bêta-2-agoniste de longue durée d’action ou par l’association d’un bêta-2-agoniste de longue durée d’action et d’un antagoniste muscarinique de longue durée d’action.
En outre, la prise en charge de la spécialité dans cette indication est subordonnée à la prescription initiale d’un médecin pneumologue.
Code CIP | Présentation |
|---|---|
34009 302 193 0 0 | TRIXEO AEROSPHERE 5 µg/7,2 µg/160 µg (formotérol, glycopyrronium, budésonide), suspension pour inhalation en flacon pressurisé, boîte de 1 inhalateur (1 × 120 doses) (laboratoires ASTRAZENECA) |
34009 550 789 3 7 | TRIXEO AEROSPHERE 5 µg/7,2 µg/160 µg (formotérol, glycopyrronium, budésonide), suspension pour inhalation en flacon pressurisé, boîte de 3 inhalateurs (3 × 120 doses) (laboratoires ASTRAZENECA) |
A l’annexe de l’arrêté du 28 juillet 2021 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux (Journal officiel du 6 août 2021, NOR : SSAS2119439A, texte 24), dans le tableau, le libellé de la spécialité pharmaceutique visée ci-dessous est rectifié comme suit :
Au lieu de :
«
Code CIP | Présentation |
|---|---|
34009 550 789 3 7 | TRIXEO AEROSPHERE 5 µg/7,2 µg/160 µg (Ffrmotérol, glycopyrronium, budésonide), suspension pour inhalation en flacon pressurisé, Boîte de 3 inhalateurs (3 × 120 doses) (laboratoires ASTRAZENECA) |
»
lire :
«
Code CIP | Présentation |
|---|---|
34009 550 789 3 7 | TRIXEO AEROSPHERE 5 µg/7,2 µg/160 µg (formotérol, glycopyrronium, budésonide), suspension pour inhalation en flacon pressurisé, boîte de 3 inhalateurs (3 × 120 doses) (laboratoires ASTRAZENECA) |
».
JORF n°0204 du 2 septembre 2021 Texte n° 29
Arrêté du 20 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
A l’annexe de l’arrêté du 28 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics (Journal officiel du 5 août 2021, NOR : SSAS2122242A), le point IV est ajouté :
« IV. – La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 310 36 | PROPIONATE DE FLUTICASONE/SALMETEROL BIOGARAN AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires BIOGARAN) |
JORF n°0204 du 2 septembre 2021 Texte n° 26
Arrêté du 18 août 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 5. Antifongiques, les spécialités suivantes sont ajoutées :
| NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
| MICAFUNGINE REIG JOFRE 100 mg, poudre pour solution à diluer pour perfusion | REIG JOFRE | 6 226 265 7 | 9001528 | MICAFUNGINE REI 100MG PERF FL |
| MICAFUNGINE REIG JOFRE 50 mg, poudre pour solution à diluer pour perfusion | REIG JOFRE | 6 910 537 7 | 9001529 | MICAFUNGINE REI 50MG PERF FL |
JORF n°0202 du 31 août 2021 Texte n° 20
Arrêté du 24 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
1. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– chez les adultes avec hypercholestérolémie (familiale hétérozygote, homozygote ou non familiale) ou une dyslipidémie mixte non contrôlée par un traitement bien conduit par une statine en monothérapie lorsque l’utilisation d’une association est appropriée ;
– chez les patients recevant déjà de l’atorvastatine et de l’ézétimibe aux mêmes doses, dans le cadre d’un traitement de substitution.
Code CIP | Présentation |
|---|---|
34009 490 045 7 7 | LIPTRUZET 10 mg/10 mg (ézétimibe, atorvastatine), comprimés pelliculés (B/30) (laboratoires BB FARMA) |
34009 490 045 8 4 | LIPTRUZET 10 mg/10 mg (ézétimibe, atorvastatine), comprimés pelliculés (B/90) (laboratoires BB FARMA) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 284 2 5 | BIKTARVY 50 mg/200 mg/25 mg (bictégravir, emtricitabine, ténofovir alafénamide), comprimés pelliculés en plaquette PVC/PE/PCTFE (B/30) (laboratoires GILEAD SCIENCES) |
34009 302 284 3 2 | BIKTARVY 50 mg/200 mg/25 mg (bictégravir, emtricitabine, ténofovir alafénamide), comprimés pelliculés en plaquette PVC/PE/PCTFE (B/90) (laboratoires GILEAD SCIENCES) |
34009 490 045 5 3 | CLOPIXOL action prolongée 200 mg/1 ml (décanoate de zuclopenthixol), solution injectable IM, 1 ml en ampoule (laboratoires DIFARMED S.L) |
34009 302 237 8 9 | CONFEROPORT 0,5 mg (tacrolimus), gélule à libération prolongée sous plaquette pré-découpée unitaire PVC/PVDC/Aluminium (B/30) (laboratoires SANDOZ) |
34009 302 238 0 2 | CONFEROPORT 1 mg (tacrolimus), gélule à libération prolongée sous plaquette pré-découpée unitaire PVC/PVDC/Aluminium (B/30) (laboratoires SANDOZ) |
34009 302 238 2 6 | CONFEROPORT 2 mg (tacrolimus), gélule à libération prolongée sous plaquette pré-découpée unitaire PVC/PVDC/Aluminium (B/30) (laboratoires SANDOZ) |
34009 302 238 4 0 | CONFEROPORT 3 mg (tacrolimus), gélule à libération prolongée sous plaquette pré-découpée unitaire PVC/PVDC/Aluminium (B/30) (laboratoires SANDOZ) |
34009 302 238 6 4 | CONFEROPORT 5 mg (tacrolimus), gélule à libération prolongée sous plaquette pré-découpée unitaire PVC/PVDC/Aluminium (B/30) (laboratoires SANDOZ) |
34009 490 045 3 9 | COVERAM 5 mg/5 mg (périndopril, amlodipine), comprimés (B/30) (laboratoires BB FARMA) |
34009 490 045 4 6 | COVERAM 5 mg/5 mg (périndopril, amlodipine), comprimés (B/90) (laboratoires BB FARMA) |
34009 301 797 3 4 | DEXOCOL 1 mg/ml (dexaméthasone), collyre en solution, 6 ml en flacon avec embout compte-gouttes (B/1) (laboratoires HORUS PHARMA) |
34009 302 186 0 0 | FIXAPOST 50 microgrammes/ml + 5 mg/ml (latanoprost, timolol), collyre en solution, 6 mL en flacon (PEHD) avec une fermeture sécurité (PEHD) (laboratoires THEA PHARMA) |
34009 490 045 9 1 | LIPOROSA 10 mg/10 mg (rosuvastatine, ézétimibe), gélules (B/30) (laboratoires BB FARMA) |
34009 490 046 0 7 | LIPOROSA 10 mg/10 mg (rosuvastatine, ézétimibe), gélules (B/90) (laboratoires BB FARMA) |
34009 490 046 6 9 | LIPOROSA 20 mg/10 mg (rosuvastatine, ézétimibe), gélules (B/30) (laboratoires BB FARMA) |
34009 490 046 7 6 | LIPOROSA 20 mg/10 mg (rosuvastatine, ézétimibe), gélules (B/90) (laboratoires BB FARMA) |
34009 490 045 0 8 | SERETIDE 50/25 microgrammes/dose (fluticasone, salmétérol), suspension pour inhalation, 120 doses en flacon pressurisé aluminium avec valve doseuse et embout buccal (laboratoires BB FARMA) |
34009 302 328 2 8 | SINETRAV 40 microgrammes/ml (travoprost), collyre en solution, 2,5 ml en flacon multidose avec système de pompe (B/3) (laboratoires HORUS PHARMA) |
34009 490 046 1 4 | VENTOLINE 100 microgrammes/dose (salbutamol), suspension pour inhalation, 200 doses en flacon pressurisé aluminium avec valve doseuse avec embout buccal (B/1) (laboratoires DIFARMED S.L) |
JORF n°0202 du 31 août 2021 Texte n° 18
Arrêté du 20 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
Polyarthrite rhumatoïde (adulte)
En association au méthotrexate, traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l’adulte lorsque la réponse aux traitements de fond, y compris le méthotrexate, est inadéquate.
Adalimumab peut être donné en monothérapie en cas d’intolérance au méthotrexate ou lorsque la poursuite du traitement avec le méthotrexate est inadaptée.
Il a été montré que l’adalimumab ralentit la progression des dommages structuraux articulaires mesurés par radiographie et améliore les capacités fonctionnelles lorsqu’il est administré en association au méthotrexate.
Spondyloarthrite axiale (adulte)
Spondylarthrite ankylosante (SA) :
Traitement de la spondylarthrite ankylosante sévère et active chez l’adulte ayant eu une réponse inadéquate au traitement conventionnel.
Spondyloarthrite axiale sans signes radiographiques de SA :
Traitement de la spondyloarthrite axiale sévère sans signes radiographiques de SA, mais avec des signes objectifs d’inflammation à l’IRM et/ou un taux élevé de CRP chez les adultes ayant eu une réponse inadéquate ou une intolérance aux anti-inflammatoires non stéroïdiens.
Rhumatisme psoriasique (adulte)
Traitement du rhumatisme psoriasique actif et évolutif chez les adultes lorsque la réponse à un traitement de fond antérieur a été inadéquate Il a été montré que l’adalimumab ralentit la progression des dommages structuraux articulaires périphériques tels que mesurés par radiographie, chez les patients ayant des formes polyarticulaires symétriques de la maladie et améliore les capacités fonctionnelles.
Arthrite juvénile idiopathique
Arthrite juvénile idiopathique polyarticulaire :
En association au méthotrexate : traitement de l’arthrite juvénile idiopathique polyarticulaire évolutive chez les patients à partir de 2 ans en cas de réponse insuffisante à un ou plusieurs traitements de fond.
Adalimumab peut être administré en monothérapie en cas d’intolérance au méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est inadaptée. Adalimumab n’a pas été étudié chez l’enfant de moins de 2 ans.
Arthrite liée à l’enthésite :
Adalimumab est indiqué pour le traitement de l’arthrite active liée à l’enthésite chez les patients à partir de 6 ans en cas de réponse insuffisante ou d’intolérance au traitement conventionnel.
Psoriasis en plaques (enfant, adolescent et adulte)
Traitement du psoriasis en plaques chronique sévère de l’enfant à partir de 4 ans, de l’adolescent et de l’adulte, défini par :
– un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie ;
– et une forme étendue et/ou un retentissement psychosocial important.
Maladie de Crohn
– adulte : traitement de la maladie de Crohn active modérée à sévère, chez les adultes qui n’ont pas répondu malgré un traitement approprié et bien conduit par un corticoïde et/ou un immunosuppresseur ; ou chez lesquels ce traitement est contre-indiqué ou mal toléré ;
– enfant et adolescent : traitement de la maladie de Crohn active sévère, chez les enfants et les adolescents à partir de 6 ans, qui n’ont pas répondu malgré un traitement conventionnel comprenant un corticoïde, un immunomodulateur et un traitement nutritionnel de première intention ; ou chez lesquels ces traitements sont contre-indiqués ou mal tolérés.
Rectocolite hémorragique
– traitement de la rectocolite hémorragique active, modérée à sévère chez les adultes qui n’ont pas répondu de manière adéquate à un traitement conventionnel comprenant les corticoïdes et l’azathioprine ou la 6-mercaptopurine, ou chez lesquels ce traitement est mal toléré ou contre-indiqué.
Uvéite
– adulte : traitement de l’uvéite non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée ;
– enfant et adolescent : en association au méthotrexate, traitement de l’uvéite antérieure chronique non infectieuse associée à une arthrite juvénile idiopathique chez l’enfant à partir de 2 ans et l’adolescent, en cas de réponse insuffisante ou d’intolérance au traitement conventionnel ou pour lesquels un traitement conventionnel est inapproprié.
Code CIP | Présentation |
|---|---|
34009 302 263 7 7 | YUFLYMA 40 mg (adalimumab), solution injectable, 0,4 ml (40 mg/0,4 ml) en seringue préremplie en verre avec protège aiguille (B/1) + 2 tampons d’alcool (laboratoires CELLTRION HEALTHCARE FRANCE SAS) |
34009 302 263 8 4 | YUFLYMA 40 mg (adalimumab), solution injectable, 0,4 ml (40 mg/0,4 ml) en seringue préremplie en verre avec protège aiguille (B/2) + 2 tampons d’alcool (laboratoires CELLTRION HEALTHCARE FRANCE SAS) |
34009 302 263 9 1 | YUFLYMA 40 mg (adalimumab), solution injectable, 0,4 ml (40 mg/0,4 ml) en seringue préremplie en verre avec protège aiguille (B/4) + 4 tampons d’alcool (laboratoires CELLTRION HEALTHCARE FRANCE SAS) |
34009 302 264 1 4 | YUFLYMA 40 mg (adalimumab), solution injectable, 0,4 ml (40 mg/0,4 ml) en seringue préremplie en verre avec protège aiguille (B/6) + 6 tampons d’alcool (laboratoires CELLTRION HEALTHCARE FRANCE SAS) |
34009 302 264 2 1 | YUFLYMA 40 mg (adalimumab), solution injectable, 0,4 ml (40 mg/0,4 ml) en stylo prérempli en verre (B/1) + 2 tampons d’alcool (laboratoires CELLTRION HEALTHCARE FRANCE SAS) |
34009 302 264 3 8 | YUFLYMA 40 mg (adalimumab), solution injectable, 0,4 ml (40 mg/0,4 ml) en stylo prérempli en verre (B/2) + 2 tampons d’alcool (laboratoires CELLTRION HEALTHCARE FRANCE SAS) |
34009 302 264 4 5 | YUFLYMA 40 mg (adalimumab), solution injectable, 0,4 ml (40 mg/0,4 ml) en stylo prérempli en verre (B/4) + 2 tampons d’alcool (laboratoires CELLTRION HEALTHCARE FRANCE SAS) |
34009 302 264 5 2 | YUFLYMA 40 mg (adalimumab), solution injectable, 0,4 ml (40 mg/0,4 ml) en stylo prérempli en verre (B/6) + 2 tampons d’alcool (laboratoires CELLTRION HEALTHCARE FRANCE SAS) |
JORF n°0198 du 26 août 2021 Texte n° 21
Arrêté du 20 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue aux indications suivantes :
– Chez l’adulte pour le traitement d’autres pneumopathies interstitielles diffuses fibrosantes chroniques avec un phénotype progressif ;
– Chez l’adulte pour le traitement de la pneumopathie interstitielle diffuse associée à la sclérodermie systémique.
Code CIP | Présentation |
|---|---|
34009 300 060 2 3 | OFEV 100 mg (nintédanib), capsules molles (B/60) (laboratoires BOEHRINGER INGELHEIM FRANCE) |
34009 300 060 4 7 | OFEV 150 mg (nintédanib), capsules molles (B/60) (laboratoires BOEHRINGER INGELHEIM FRANCE) |
JORF n°0198 du 26 août 2021 Texte n° 19
Arrêté du 20 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
1. La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– en association au rituximab pour le traitement de 1re ligne de la leucémie lymphoïde chronique (LLC), uniquement chez les patients éligibles à un traitement à base de fludarabine à pleine dose et ne présentant pas de délétion del17p ni de mutation TP53.
Code CIP | Présentation |
|---|---|
34009 301 824 8 2 | IMBRUVICA 140 mg (ibrutinib), comprimés pelliculés (B/30) (laboratoires JANSSEN-CILAG) |
34009 279 499 0 6 | IMBRUVICA 140 mg (ibrutinib), gélules (B/120) (laboratoires JANSSEN-CILAG) |
34009 279 498 4 5 | IMBRUVICA 140 mg (ibrutinib), gélules (B/90) (laboratoires JANSSEN-CILAG) |
34009 301 825 0 5 | IMBRUVICA 280 mg (ibrutinib), comprimés pelliculés (B/30) (laboratoires JANSSEN-CILAG) |
34009 301 561 6 2 | IMBRUVICA 420 mg (ibrutinib), comprimés pelliculés (B/30) (laboratoires JANSSEN-CILAG) |
34009 301 561 7 9 | IMBRUVICA 560 mg (ibrutinib), comprimés pelliculés (B/30) (laboratoires JANSSEN-CILAG) |
2. La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– uniquement en 2e ligne et plus dans le traitement du cancer du poumon non à petites cellules (CPNPC) au stade avancé avec un réarrangement ROS1.
Code CIP | Présentation |
|---|---|
34009 267 626 2 9 | XALKORI 200 mg (crizotinib), gélules en flacon (B/60) (laboratoires PFIZER) |
34009 267 625 6 8 | XALKORI 200 mg (crizotinib), gélules en plaquettes thermoformées (B/60) (laboratoires PFIZER) |
34009 267 628 5 8 | XALKORI 250 mg (crizotinib), gélules en flacon (B/60) (laboratoires PFIZER) |
34009 267 627 9 7 | XALKORI 250 mg (crizotinib), gélules en plaquettes thermoformées (B/60) (laboratoires PFIZER) |
JORF n°0196 du 24 août 2021 Texte n° 14
Arrêté du 17 août 2021 modifiant l’arrêté du 28 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La première partie de l’annexe de l’arrêté du 28 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics, publié au Journal officiel du 4 août 2021 (NOR : SSAS2119400A, texte n° 31) est ainsi modifiée :
1. Au point 2, les deux lignes suivantes sont supprimées :
34009 301 821 9 2 | TALZENNA 0,25 mg (talazoparib), gélules en flacon (B/30) (laboratoires PFIZER) |
34009 301 822 0 8 | TALZENNA 1 mg (talazoparib), gélules en flacon (B/30) (laboratoires PFIZER) |
2. Il est ajouté un point 3 ainsi rédigé :
« Les spécialités pharmaceutiques suivantes sont inscrites à compter du 1er septembre 2021 sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
« Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
34009 301 821 9 2 | TALZENNA 0,25 mg (talazoparib), gélules en flacon (B/30) (laboratoires PFIZER) |
34009 301 822 0 8 | TALZENNA 1 mg (talazoparib), gélules en flacon (B/30) (laboratoires PFIZER) |
JORF n°0190 du 17 août 2021 Texte n° 12
Arrêté du 13 août 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, à compter du 1er janvier 2022, les codes suivants sont radiés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 3, sous-section 1, paragraphe 5 | 3128976, 3187938, 3115583 | Implants du rachis |
A l’annexe de l’arrêté du 2 mars 2005 susvisé, dès la publication de cet arrêté au Journal officiel de la République française, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 3, sous-section 1, paragraphe 5 | 3120242, 3164699, 3129823, 3178477, 3141468, 3185394, 3165919, 3177851, 3183024, 3198362, 3144930, 3171156, 3192030, 3117866, 3112389, 3185336 | Implants du rachis |
JORF n°0186 du 12 août 2021 Texte n° 39
Arrêté du 5 août 2021 portant modification des conditions d’inscription de l’endoprothèse coronaire enrobée d’évérolimus XIENCE XPEDITION 48 de la société ABBOTT MEDICAL France inscrite au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0186 du 12 août 2021 Texte n° 38
Arrêté du 5 août 2021 modifiant la liste des médicaments agréés à l’usage des collectivités et divers services publics mentionnée à l’article L. 5123-2 du code de la santé publique
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour les spécialités mentionnées ci-dessous :
– chez les patients adultes présentant un épisode de purpura thrombotique thrombocytopénique acquis (PTTa) conjointement à un traitement par échanges plasmatiques et par immunosuppresseurs.
Code CIP | Présentation |
|---|---|
34009 301 551 1 0 | CABLIVI 10 mg (caplacizumab), poudre et solvant pour solution injectable, poudre : flacon (verre), solvant : seringue préremplie (verre), poudre 10 mg, solvant A ml, boîte de 1 flacon de poudre, 1 seringue préremplie de solvant, 1 adaptateur pour flacon, 1 aiguille hypodermique (30G), 2 tampons imbibés d’alcool (laboratoires SANOFI AVENTIS FRANCE) |
34009 301 727 5 9 | CABLIVI 10 mg (caplacizumab), poudre et solvant pour solution injectable, poudre : flacon (verre), solvant : seringue préremplie (verre), poudre : 10 mg, solvant : 1 ml, boîte de 7 (7×1) flacons de poudre, 7 (7×1) seringues préremplies de solvant, 7 (7×1) adaptateurs de flacon, 7 (7×1) aiguilles hypodermiques, 14 (7×2) tampons (boîte multidoses) (laboratoires SANOFI AVENTIS FRANCE) |
L’arrêté du 9 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics (NOR : SSAS2116418A, Journal officiel de la République française du 15 juin 2021) est abrogé.
JORF n°0186 du 12 août 2021 Texte n° 37
Arrêté du 4 août 2021 portant modification des conditions d’inscription du système d’athérectomie rotationnelle ROTAPRO de la société BOSTON SCIENTIFIC inscrit au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0185 du 11 août 2021 Texte n° 25
Arrêté du 6 août 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit.
Anciens libellés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 301 732 4 4 | CUTAQUID 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 12 ml (B/1) (Laboratoires OCTAPHARMA FRANCE) | 34009 301 732 4 4 | CUTAQUIG 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 12 ml (B/1) (Laboratoires OCTAPHARMA FRANCE) |
34009 301 732 6 8 | CUTAQUID 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 24 ml (B/1) (Laboratoires OCTAPHARMA FRANCE) | 34009 301 732 6 8 | CUTAQUIG 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 24 ml (B/1) (Laboratoires OCTAPHARMA FRANCE) |
34009 301 732 7 5 | CUTAQUID 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 48 ml (B/1) (Laboratoires OCTAPHARMA FRANCE) | 34009 301 732 7 5 | CUTAQUIG 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 48 ml (B/1) (Laboratoires OCTAPHARMA FRANCE) |
34009 301 732 2 0 | CUTAQUID 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 6 ml (B/1) (Laboratoires OCTAPHARMA FRANCE) | 34009 301 732 2 0 | CUTAQUIG 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 6 ml (B/1) (Laboratoires OCTAPHARMA FRANCE) |
JORF n°0185 du 11 août 2021 Texte n° 24
Arrêté du 5 août 2021 relatif à l’arrêt de la prise en charge de spécialités pharmaceutiques au titre de l’article L. 162-16-5-1-1 du code de la sécurité sociale dans sa rédaction antérieure au 1er juillet 2021
Il est mis fin à la prise en charge mentionnée au I de l’article L. 162-16-5-1-1 du code de la sécurité sociale dans sa rédaction antérieure au 1er juillet 2021 de la spécialité pharmaceutique bénéficiant d’une autorisation temporaire d’utilisation de cohorte conformément aux dispositions qui figurent en annexe.
ANNEXE
(1 arrêt de prise en charge)
Il est mis fin à la prise en charge mentionnée au I de l’article L. 162-16-5-1-1 du code de la sécurité sociale dans sa rédaction antérieure au 1er juillet 2021 de la spécialité pharmaceutique mentionnée ci-dessous :
Spécialité pharmaceutique | Indication thérapeutique | Code UCD 7 | Libellé de l’UCD | Laboratoire exploitant |
|---|---|---|---|---|
ATEZOLIZUMAB 840 mg, solution à diluer pour perfusion (ATEZOLIZUMAB) | En association au paclitaxel et au nabpaclitaxel, est indiqué dans le traitement des patients adultes atteints d’un cancer du sein triple négatif localement avancé non résécable ou métastatique, dont les tumeurs présentent une expression de PD-L1 ≥ 1% et n’ayant pas précédemment reçu de chimiothérapie en situation métastatique. | 9451431 | ATEZOLIZUMAB RCH 840MG INJ FL | Roche |
JORF n°0184 du 10 août 2021 Texte n° 9
Arrêté du 4 août 2021 relatif à l’arrêt de la prise en charge de spécialités pharmaceutiques au titre du VI l’article L. 162-16-5-2 du code de la sécurité sociale
A compter du 31 janvier 2022, il est mis fin à la prise en charge mentionnée au VI de l’article L. 162-16-5-2 du code de la sécurité sociale de la spécialité pharmaceutique mentionnée ci-dessous :
Spécialité pharmaceutique | Indication thérapeutique | Code UCD 7 | Libellé de l’UCD | Laboratoire exploitant |
|---|---|---|---|---|
DECTOVA 10 mg/1 mL, solution pour perfusion (Zanamivir) | Chez l’adulte et l’enfant âgé de 6 mois et plus dans le traitement de l’infection grippale compliquée (virus de la grippe A ou B) et pouvant mettre en jeu le pronostic vital lorsque : • Le virus de la grippe du patient infecté présente une résistance connue ou suspectée aux médicaments antigrippaux autres que zanamivir, et/ou ; • Les autres médicaments antiviraux indiqués dans le traitement de la grippe, y compris le zanamivir par voie inhalée, ne sont pas appropriés pour le patient.) | 9452554 | DECTOVA 10MG/1ML PERF FL20ML | GlaxoSmithKline |
JORF n°0182 du 7 août 2021 Texte n° 29
Décret n° 2021-1048 du 4 août 2021 relatif à la mise en œuvre de l’espace numérique de santé
JORF n°0182 du 7 août 2021 Texte n° 28
Décret n° 2021-1047 du 4 août 2021 relatif au dossier médical partagé
JORF n°0181 du 6 août 2021 Texte n° 28
Arrêté du 4 août 2021 limitant l’utilisation de médicaments de thérapie génique indiqués dans le traitement de la dystrophie rétinienne héréditaire à certains établissements de santé en application des dispositions de l’article L. 1151-1 du code de la santé publique
JORF n°0181 du 6 août 2021 Texte n° 27
Arrêté du 4 août 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La spécialité suivante est inscrite sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
La seule indication thérapeutique ouvrant droit à la prise en charge en sus par l’assurance maladie est, pour la spécialité ci-dessous :
– le traitement des patients adultes et des enfants présentant une perte visuelle dur à une dystrophie rétinienne héréditaire résultant de mutations bi-alléliques conformée du gène RPE65 et possédant suffisamment de cellules rétiniennes viables.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
voretigène néparvovec | LUXTURNA 5 × 10 génomes de vecteur/mL, solution à diluer et solvant pour solution injectable | 3400894437857 | LUXTURNA INJ FL+FL | NOVARTIS PHARMA SAS |
JORF n°0181 du 6 août 2021 Texte n° 26
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
L’indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
– traitement des patients adultes et des enfants présentant une perte visuelle due à une dystrophie rétinienne héréditaire résultant de mutations bi-alléliques confirmées du gène RPE65 et possédant suffisamment de cellules rétiniennes viables.
Par ailleurs, cette prise en charge est subordonnée aux conditions de prescription et au mode d’organisation des soins suivants :
– la décision de mise sous traitement doit faire l’objet d’une réunion de concertation pluridisciplinaire et doit reposer sur un faisceau d’examens, notamment pour déterminer le nombre de cellules rétiniennes viables suffisant, comportant un test génétique, des examens d’imagerie (tomographie en cohérence optique, optique adaptative), électrorétinogramme et des examens psychophysiques tels que la pupillométrie, l’acuité visuelle, le champ visuel et le test de mobilité en ambiance lumineuse variable (MLMT).
Code CIP | Présentation |
|---|---|
34009 550 607 9 6 | LUXTURNA 5×1012 génomes de vecteur/ml (voretigene neparvovec), solution à diluer et solvant pour solution injectable, solution à diluer : flacon (COC) ; solvant : flacon (COC), solution à diluer : 0,5 ml ; solvant : 1,7 ml, boîte de 1 flacon de solution à diluer + 2 flacons de solvant (laboratoires NOVARTIS PHARMA SAS) |
JORF n°0181 du 6 août 2021 Texte n° 25
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
A compter du 1er octobre 2021, les spécialités pharmaceutiques suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Traitement de substitution chez les adultes, les enfants et les adolescents (0-18 ans) atteints de :
– déficit immunitaire primitif avec production défaillante d’anticorps ;
– hypogammaglobulinémie et infections bactériennes récurrentes chez les patients atteints de leucémie lymphoïde chronique (LLC) chez qui la prophylaxie antibiotique a échoué ou est contreindiquée ;
– hypogammaglobulinémie et infections bactériennes récurrentes chez les patients atteints de myélome multiple (MM) ;
– hypogammaglobulinémie chez des patients en pré et post transplantation de cellules souches hématopoïétiques allogéniques (GCSH).
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
Immunoglobuline humaine normale | CUTAQUIG 165 mg/mL, solution injectable par voie sous-cutanée | 3400890011006 | CUTAQUIG 165MG/ML INJ FL12ML | OCTAPHARMA |
Immunoglobuline humaine normale | CUTAQUIG 165 mg/mL, solution injectable par voie sous-cutanée | 3400890011013 | CUTAQUIG 165MG/ML INJ FL24ML | OCTAPHARMA |
Immunoglobuline humaine normale | CUTAQUIG 165 mg/mL, solution injectable par voie sous-cutanée | 3400890011020 | CUTAQUIG 165MG/ML INJ FL48ML | OCTAPHARMA |
Immunoglobuline humaine normale | CUTAQUIG 165 mg/mL, solution injectable par voie sous-cutanée | 3400890011037 | CUTAQUIG 165MG/ML INJ FL6ML | OCTAPHARMA |
JORF n°0181 du 6 août 2021 Texte n° 24
Arrêté du 28 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour les spécialités visées ci-dessous :
– traitement continu de la bronchopneumopathie chronique obstructive (BPCO) sévère chez les adultes traités de façon satisfaisante par l’association d’un corticostéroïde inhalé et d’un bêta-2-agoniste de longue durée d’action ou par l’association d’un bêta-2-agoniste de longue durée d’action et d’un antagoniste muscarinique de longue durée d’action.
En outre, la prise en charge de la spécialité dans cette indication est subordonnée à la prescription initiale d’un médecin pneumologue.
Code CIP | Présentation |
|---|---|
34009 550 789 3 7 | TRIXEO AEROSPHERE 5 µg/7,2 µg/160 µg (Ffrmotérol, glycopyrronium, budésonide), suspension pour inhalation en flacon pressurisé, Boîte de 3 inhalateurs (3 x 120 doses) (laboratoires ASTRAZENECA) |
34009 302 193 0 0 | TRIXEO AEROSPHERE 5 µg/7,2 µg/160 µg (formotérol, glycopyrronium, budésonide), suspension pour inhalation en flacon pressurisé, boite de 1 inhalateur (1 x 120 doses) (laboratoires ASTRAZENECA) |
JORF n°0181 du 6 août 2021 Texte n° 22
Arrêté du 28 mai 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie et à la suppression de la participation de l’assuré sont celles qui figurent dans l’autorisation de mise sur le marché à la date de la publication du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 110 0 6 | CUTAQUIG 165MG/ML INJ FL12ML | OCTAPHARMA FRANCE |
| 34008 900 110 1 3 | CUTAQUIG 165MG/ML INJ FL24ML | OCTAPHARMA FRANCE |
| 34008 900 110 2 0 | CUTAQUIG 165MG/ML INJ FL48ML | OCTAPHARMA FRANCE |
| 34008 900 110 3 7 | CUTAQUIG 165MG/ML INJ FL6ML | OCTAPHARMA FRANCE |
JORF n°0181 du 6 août 2021 Texte n° 21
Arrêté du 28 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics, à compter du 1er octobre 2021.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 301 732 4 4 | CUTAQUID 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 12 ml (B/1) (laboratoires OCTAPHARMA FRANCE) |
34009 301 732 6 8 | CUTAQUID 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 24 ml (B/1) (laboratoires OCTAPHARMA FRANCE) |
34009 301 732 7 5 | CUTAQUID 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 48 ml (B/1) (laboratoires OCTAPHARMA FRANCE) |
34009 301 732 2 0 | CUTAQUID 165 mg/ml (immunoglobuline humaine normale), solution injectable, flacon (verre) de 6 ml (B/1) (laboratoires OCTAPHARMA FRANCE) |
JORF n°0181 du 6 août 2021 Texte n° 20
Décret n° 2021-1041 du 4 août 2021 relatif à l’importation et à la distribution parallèles de médicaments
JORF n°0180 du 5 août 2021 Texte n° 26
Arrêté du 29 juillet 2021 modifiant l’arrêté du 30 novembre 2020 relatif à l’expérimentation de suivi à domicile des patients sous anticancéreux oraux
JORF n°0180 du 5 août 2021 Texte n° 24
(34 inscriptions)
I. – Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 225 2 2 | SUNITINIB ZENTIVA 12,5 mg, gélules sous plaquettes (Aluminium-OPA/Aluminium/PVC) (B/28) (laboratoires ZENTIVA FRANCE) |
34009 302 225 3 9 | SUNITINIB ZENTIVA 12,5 mg, gélules sous plaquettes prédécoupées unitaires (Aluminium-OPA/Aluminium/PVC) (B/28×1) (laboratoires ZENTIVA FRANCE) |
34009 302 225 7 7 | SUNITINIB ZENTIVA 25 mg, gélules sous plaquettes (Aluminium-OPA/Aluminium/PVC) (B/28) (laboratoires ZENTIVA FRANCE) |
34009 302 225 8 4 | SUNITINIB ZENTIVA 25 mg, gélules sous plaquettes prédécoupées unitaires (Aluminium-OPA/Aluminium/PVC) (B/28×1) (laboratoires ZENTIVA FRANCE) |
34009 302 226 6 9 | SUNITINIB ZENTIVA 50 mg, gélules sous plaquettes (Aluminium-OPA/Aluminium/PVC) (B/28) (laboratoires ZENTIVA FRANCE) |
34009 302 226 7 6 | SUNITINIB ZENTIVA 50 mg, gélules sous plaquettes prédécoupées unitaires (Aluminium-OPA/Aluminium/PVC) (B/28×1) (laboratoires ZENTIVA FRANCE) |
II. – Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 271 5 2 | ACIDE ZOLEDRONIQUE BIOGARAN 4 mg/100 ml, solution pour perfusion, 100 ml en poche en polypropylène (B/1) (laboratoires BIOGARAN) |
34009 302 301 6 9 | BACLOFENE EG 10 mg, comprimés sécables (B/30) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 292 0 0 | BISOPROLOL NOR 10 mg, comprimés pelliculés sécables (B/30) (laboratoires BIOGARAN) |
34009 302 292 5 5 | BISOPROLOL NOR 10 mg, comprimés pelliculés sécables (B/90) (laboratoires BIOGARAN) |
34009 302 253 0 1 | BISOPROLOL ZENTIVA K.S 1,25 mg, comprimés (B/30) (laboratoires ZENTIVA FRANCE) |
34009 302 253 2 5 | BISOPROLOL ZENTIVA K.S 1,25 mg, comprimés (B/90) (laboratoires ZENTIVA FRANCE) |
34009 302 254 1 7 | BISOPROLOL ZENTIVA K.S 2,5 mg, comprimés (B/30) (laboratoires ZENTIVA FRANCE) |
34009 302 254 3 1 | BISOPROLOL ZENTIVA K.S 2,5 mg, comprimés (B/90) (laboratoires ZENTIVA FRANCE) |
34009 302 255 0 9 | BISOPROLOL ZENTIVA K.S 3,75 mg, comprimés (B/30) (laboratoires ZENTIVA FRANCE) |
34009 302 257 2 1 | BISOPROLOL ZENTIVA K.S 7,5 mg, comprimés (B/30) (laboratoires ZENTIVA FRANCE) |
34009 302 263 0 8 | ENALAPRIL/LERCANIDIPINE ARROW 20 mg/20 mg, comprimés pelliculés (B/30) (laboratoires ARROW GENERIQUES) |
34009 302 263 1 5 | ENALAPRIL/LERCANIDIPINE ARROW 20 mg/20 mg, comprimés pelliculés (B/90) (laboratoires ARROW GENERIQUES) |
34009 301 606 4 0 | FROVATRIPTAN BIOGARAN 2,5 mg, comprimés pelliculés (B/12) (laboratoires BIOGARAN) |
34009 302 296 3 7 | LACOSAMIDE ARROW 100 mg, comprimés pelliculés sécables (B/56) (laboratoires ARROW GENERIQUES) |
34009 302 296 4 4 | LACOSAMIDE ARROW 150 mg, comprimés pelliculés sécables (B/56) (laboratoires ARROW GENERIQUES) |
34009 302 296 5 1 | LACOSAMIDE ARROW 200 mg, comprimés pelliculés sécables (B/56) (laboratoires ARROW GENERIQUES) |
34009 302 296 2 0 | LACOSAMIDE ARROW 50 mg, comprimés pelliculés (B/56) (laboratoires ARROW GENERIQUES) |
34009 302 310 4 3 | PROPIONATE DE FLUTICASONE/SALMETEROL BIOGARAN AIRMASTER 250 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires BIOGARAN) |
34009 302 310 5 0 | PROPIONATE DE FLUTICASONE/SALMETEROL BIOGARAN AIRMASTER 500 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires BIOGARAN) |
34009 302 215 6 3 | PROPIONATE DE FLUTICASONE/SALMETEROL EG AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 215 9 4 | PROPIONATE DE FLUTICASONE/SALMETEROL EG AIRMASTER 250 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 216 2 4 | PROPIONATE DE FLUTICASONE/SALMETEROL EG AIRMASTER 500 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose (B/60) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 302 1 3 | ZOPICLONE CRISTERS PHARMA 7,5 mg, comprimés pelliculés sécables (B/14) (laboratoires CRISTERS) |
34009 302 301 9 0 | ZOPICLONE CRISTERS PHARMA 7,5 mg, comprimés pelliculés sécables (B/5) (laboratoires CRISTERS) |
III. – Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté à l’exception du traitement de courte durée (jusqu’à 6 semaines) de l’agressivité persistante chez les patients présentant une démence d’Alzheimer modérée à sévère ne répondant pas aux approches non pharmacologiques et lorsqu’il existe un risque de préjudice pour le patient lui-même ou les autres.
34009 302 297 5 0 | RISPERIDONE ZENTIVA 1 mg, comprimés pelliculés sécables sous plaquettes (PVC/PVDC-Aluminium) (B/60) (laboratoires ZENTIVA FRANCE) |
34009 302 298 6 6 | RISPERIDONE ZENTIVA 2 mg, comprimés pelliculés sécables sous plaquettes (PVC/PVDC-Aluminium) (B/60) (laboratoires ZENTIVA FRANCE) |
34009 302 299 2 7 | RISPERIDONE ZENTIVA 4 mg, comprimés pelliculés sécables sous plaquettes (PVC/PVDC-Aluminium) (B/30) (laboratoires ZENTIVA FRANCE) |
JORF n°0179 du 4 août 2021 Texte n° 47
Arrêté du 30 juillet 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 1. Médicaments dérivés du sang, la spécialité suivante est ajoutée :
| NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
| FIBRYGA 1 g, poudre et solvant pour solution injectable/pour perfusion | OCTAPHARMA FRANCE | 6 976 812 3 | 9429319 | FIBRYGA 1G INJ FL+FL50ML +NEC |
JORF n°0179 du 4 août 2021 Texte n° 46
Arrêté du 30 juillet 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7 Anticancéreux, la spécialité suivante est ajoutée :
«
| NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
| BORTEZOMIB FRESENIUS KABI 2,5 mg, poudre pour solution injectable | FRESENIUS KABI FRANCE | 6 260 079 9 | 9001302 | BORTEZOMIB FRK 2,5MG INJ FL |
JORF n°0179 du 4 août 2021 Texte n° 45
Arrêté du 30 juillet 2021 relatif à l’arrêt de la prise en charge précoce de spécialités pharmaceutiques au titre de l’article L. 162-16-5-1 du code de la sécurité sociale
Il est mis fin à la prise en charge précoce mentionnée à l’article L. 162-16-5-1 du code de la sécurité sociale de la spécialité pharmaceutique mentionnée ci-dessous :
Spécialité pharmaceutique | Indication thérapeutique | Code UCD 7 | Libellé de l’UCD | Laboratoire exploitant |
|---|---|---|---|---|
POLIVY 140 mg, poudre pour solution à diluer pour perfusion (Polatuzumab vedotin) | En association à la bendamustine et au rituximab, est indiqué dans le traitement des patients adultes présentant un lymphome diffus à grandes cellules B (LDGCB) en rechute ou réfractaire (R/R), non candidats à une greffe de cellules souches hématopoïétiques. | 9000282 | POLIVY 140MG PERF FL | ROCHE |
JORF n°0179 du 4 août 2021 Texte n° 44
Arrêté du 30 juillet 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une autorisation temporaire d’utilisation et pris en application de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code dans leurs rédactions antérieures au 1er juillet 2021
En application de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code susmentionnés et dans le cadre de l’autorisation temporaire d’utilisation de cohorte mentionnée à l’article L. 5121-12 du code de la santé publique susmentionné dont elle a fait l’objet, la spécialité pharmaceutique mentionnée en annexe du présent arrêté est prise en charge par l’assurance maladie, dans l’indication mentionnée dans ladite annexe.
La spécialité pharmaceutique qui figure en annexe, pour l’indication mentionnée dans ladite annexe, est fournie, achetée, utilisée et prise en charges par les établissements de santé conformément à l’article L. 5123-2 du code de la santé publique au titre de cette autorisation temporaire d’utilisation.
Elle est vendue au public et au détail, au titre de cette autorisation temporaire d’utilisation, par les seules pharmacies à usage intérieur autorisées, conformément aux dispositions mentionnées aux articles L. 5126-6 et R. 5126-60 du code de la santé publique. Elle donne lieu à remboursement ou prise en charge dans ce cadre sans participation de l’assuré en application des dispositions de l’article R. 160-8 susvisé.
La spécialité pharmaceutique qui figure en annexe est soumise à prescription hospitalière. Cette prescription est réservée aux néphrologues. Conformément à l’arrêté du 11 octobre 2019 susmentionné et en application du III de l’article R. 163-32-1 du code de la sécurité sociale susmentionné, le prescripteur indique sur l’ordonnance la mention : « La prise en charge de cette spécialité intervient dans le cadre d’une prise en charge “précoce” par l’assurance maladie. A ce titre, cette prise en charge ne peut être que transitoire. »
ANNEXE
(1 spécialité)
La spécialité suivante est prise en charge au titre de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code dans leur rédaction antérieure au 1er juillet 2021 dans l’indication thérapeutique suivante :
– Le traitement de la maladie rénale chronique chez l’adulte :
– en association à un traitement standard optimisé (inhibiteur de l’enzyme de conversion (IEC) ou antagoniste du récepteur de l’Angiotensine II (sartans), sauf si contre-indication) ;
– avec un débit de filtration glomérulaire (DFG) compris entre 25 et 75 mL/min/1,73m2 et un rapport albumine / créatinine urinaire compris entre 200 et 5 000 mg/g ;
– insuffisamment contrôlée malgré des thérapeutiques médicamenteuses bien conduites : IEC ou sartans.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
Dapagliflozine | FORXIGA 10 mg, comprimé pelliculé | 3400894501244 | FORXIGA 10MG CPR | Astra Zeneca |
JORF n°0179 du 4 août 2021 Texte n° 43
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutique ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant un syndrome myélodysplasique (SMD) de risque intermédiaire-2 ou élevé selon l’index pronostique international (International Prognostic Scoring System, IPSS) ;
– traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant une leucémie myélomonocytaire chronique (LMMC) avec 10 à 29 % de blastes médullaires sans syndrome myéloprolifératif ;
– traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant : une leucémie aiguë myéloblastique (LAM) avec 20 à 30 % de blastes et dysplasie de lignées multiples, selon la classification de l’Organisation Mondiale de la Santé (OMS).
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
Azacitidine | AZACITIDINE EVER PHARMA 25 mg/mL, poudre pour suspension injectable | 3400890014014 | AZACITIDINE ERP 25MG/ML F100MG | EVER Pharma France SAS |
Azacitidine | AZACITIDINE EVER PHARMA 25 mg/mL, poudre pour suspension injectable | 3400890014021 | AZACITIDINE ERP 25MG/ML F150MG | EVER Pharma France SAS |
JORF n°0179 du 4 août 2021 Texte n° 42
Arrêté du 30 juillet 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie, sont, pour le traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant :
– un syndrome myélodysplasique (SMD) de risque intermédiaire 2 ou élevé selon l’index pronostique international (International Prognostic Scoring System, IPSS) ;
– une leucémie myélomonocytaire chronique (LMMC) avec 10 à 29 % de blastes médullaires sans syndrome myéloprolifératif ;
– une leucémie aiguë myéloblastique (LAM) avec 20 à 30 % de blastes et dysplasie de lignées multiples, selon la classification de l’Organisation Mondiale de la Santé (OMS).
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 140 1 4 | AZACITIDINE ERP 25MG/ML F100MG | EVER PHARMA FRANCE |
| 34008 900 140 2 1 | AZACITIDINE ERP 25MG/ML F150MG | EVER PHARMA FRANCE |
JORF n°0179 du 4 août 2021 Texte n° 41
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie, sont, pour le traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant :
– un syndrome myélodysplasique (SMD) de risque intermédiaire 2 ou élevé selon l’index pronostique international (International Prognostic Scoring System, IPSS) ;
– une leucémie myélomonocytaire chronique (LMMC) avec 10 à 29 % de blastes médullaires sans syndrome myéloprolifératif ;
– une leucémie aiguë myéloblastique (LAM) avec 20 à 30 % de blastes et dysplasie de lignées multiples, selon la classification de l’Organisation Mondiale de la Santé (OMS).
Code CIP | Présentation |
|---|---|
34009 302 210 5 1 | AZACITIDINE EVER PHARMA 25 mg/ml, poudre pour suspension injectable, flacon (verre) de 100 mg (B/1) (laboratoires EVER PHARMA FRANCE) |
34009 302 210 6 8 | AZACITIDINE EVER PHARMA 25 mg/ml, poudre pour suspension injectable, flacon (verre) de 150 mg (B/1) (laboratoires EVER PHARMA FRANCE) |
JORF n°0179 du 4 août 2021 Texte n° 40
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
L’indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie, pour la spécialité visée ci-dessous, concerne uniquement en traitement de dernier recours chez les patients adultes en situation d’urgence notamment en cas de décompensation réfractaire, en échec de sevrage aux inotropes ou à l’assistance circulatoire.
Code CIP | Présentation |
|---|---|
34009 550 813 8 8 | LEVOSIMENDAN ALTAN 2,5 mg/ml, solution à diluer pour perfusion, flacon (verre) de 5 ml (B/1) (laboratoires MEDIPHA SANTE) |
JORF n°0179 du 4 août 2021 Texte n° 39
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Mésothéliome pleural malin : En association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure.
– Cancer bronchique non à petites cellules :
– en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde ;
– en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé ;
– en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
pemetrexed | PEMETREXED HOSPIRA 25 mg/ml, solution à diluer pour perfusion | 3400890011105 | PEMETREXED HPI 25MG/ML FL20ML | PFIZER |
pemetrexed | PEMETREXED HOSPIRA 25 mg/ml, solution à diluer pour perfusion | 3400890011129 | PEMETREXED HPI 25MG/ML FL40ML | PFIZER |
pemetrexed | PEMETREXED HOSPIRA 25 mg/ml, solution à diluer pour perfusion | 3400890011112 | PEMETREXED HPI 25MG/ML FL4ML | PFIZER |
JORF n°0179 du 4 août 2021 Texte n° 38
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutique ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– en association à une chimiothérapie à base de fluoropyrimidine, est indiqué chez les patients adultes atteints de cancer colorectal métastatique.
– traitement de première ligne des patients atteints de cancer bronchique non à petites cellules, avancé et non opérable, métastatique ou en stade de rechute, dès lors que l’histologie n’est pas à prédominance épidermoïde, en association à une chimiothérapie à base de sels de platine.
– en association au carboplatine et au paclitaxel, traitement de 1ère ligne des stades avancés (stades FIGO III B, III C et IV) du cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif chez des patientes adultes.
– en association au carboplatine et à la gemcitabine, est indiqué chez les patientes adultes atteintes d’un cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif, en première récidive, sensible aux sels de platine et qui n’ont pas été préalablement traitées par du bevacizumab ou d’autres inhibiteurs du VEGF ou d’autres agents ciblant le récepteur du VEGF.
– en association au topotécan ou à la doxorubicine liposomale pégylée, est indiqué chez les patientes adultes atteintes d’un cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif, en rechute, résistant aux sels de platine, qui n’ont pas reçu plus de deux protocoles antérieurs de chimiothérapie et qui n’ont pas été préalablement traitées par du bevacizumab ou d’autres inhibiteurs du VEGF ou d’autres agents ciblant le récepteur du VEGF.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
bévacizumab | OYAVAS 25 mg/ml, solution à diluer pour perfusion | 3400890012706 | OYAVAS 25MG/ML PERF FL16ML | EG LABO – LABORATOIRES EUROGENERICS |
bévacizumab | OYAVAS 25 mg/ml, solution à diluer pour perfusion | 3400890012713 | OYAVAS 25MG/ML PERF FL4ML | EG LABO – LABORATOIRES EUROGENERICS |
JORF n°0179 du 4 août 2021 Texte n° 37
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue à l’indication suivante :
– traitement de la maladie du spectre de la neuromyélite optique (NMOSD) chez les patients adultes ayant des anticorps anti-aquaporine 4 (AQP4) atteints de la forme récurrente de la maladie (2 crises au cours de la dernière année ou 3 crises au cours des deux dernières années dont une au cours de l’année précédente), et étant en échec des traitements de fond immunosuppresseurs (rituximab, azathioprine, mycophénolate mofétil).
– par ailleurs, cette prise en charge est subordonnée aux conditions de prescription et au mode d’organisation des soins suivants :
La prise en charge doit être faite dans un centre de ressources et de compétences sclérose en plaques ou dans un centre du réseau MIRCEM (maladies inflammatoires rares du cerveau et de la moelle), avec une prescription restreinte aux neurologues dans le cadre d’une RCP pluridisciplinaire, justifiée au regard du risque d’utilisation de SOLIRIS au-delà du périmètre de remboursement défini par la Commission sur la base des données disponibles d’efficacité et de tolérance, notamment une utilisation en 1ère intention ou chez des patients n’ayant pas d’anticorps anti-AQP4 (hors AMM).
Code CIP | Présentation |
|---|---|
34009 571 138 4 1 | SOLIRIS 300 mg (eculizumab), solution à diluer pour perfusion, flacon en verre de 30 ml (10 mg/ml) (B/1) (laboratoires ALEXION PHARMA FRANCE) |
JORF n°0179 du 4 août 2021 Texte n° 36
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
(1 modification)
Le laboratoire exploitant de la spécialité pharmaceutique suivante est modifié comme suit :
Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant précédent | Nouveau laboratoire exploitant |
|---|---|---|---|---|---|
fidaxomicine | DIFICLIR 200 mg, comprimé pelliculé | 3400893843734 | DIFICLIR 200MG CPR | ASTELLAS PHARMA | TILLOTTS PHARMA FRANCE SAS |
Extension d’indication
La prise en charge en sus des prestations d’hospitalisation des spécialités ci-dessous est étendue à l’indication suivante :
– le traitement des infections à Clostridioides difficile (ICD), appelées également diarrhées associées à C. difficile (DACD) chez les patients pédiatriques pesant au moins 12,5 kg.
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des antibactériens.
Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
fidaxomicine | DIFICLIR 200 mg, comprimé pelliculé | 3400893843734 | DIFICLIR 200MG CPR | TILLOTTS PHARMA FRANCE S.A.S |
(1 inscription)
La spécialité suivante est inscrite sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
La seule indication thérapeutique ouvrant droit à la prise en charge en sus par l’assurance maladie est, pour la spécialité visée ci-dessous :
– le traitement des infections à Clostridioides difficile (ICD), appelées également diarrhées associées à C. difficile (DACD) chez les patients adultes et chez les patients pédiatriques de la naissance à moins de 18 ans.
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des antibactériens.
Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
fidaxomicine | DIFICLIR 40 mg/mL, granulés pour suspension buvable | 3400890010344 | DIFICLIR 40MG/ML BUV GLE FL | TILLOTTS PHARMA FRANCE S.A.S |
JORF n°0179 du 4 août 2021 Texte n° 35
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La prise en charge en sus des prestations d’hospitalisation de la spécialité ci-dessous est étendue à l’indication suivante :
– traitement de la maladie du spectre de la neuromyélite optique chez les patients adultes ayant des anticorps anti-aquaporine 4 atteints de la forme récurrente de la maladie (2 crises au cours de la dernière année ou 3 crises au cours des deux dernières années dont une au cours de l’année précédente), et étant en échec des traitements de fond immunosuppresseurs (rituximab, azathioprine, mycophénolate mofétil).
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
eculizumab | SOLIRIS 300 mg, solution à diluer pour perfusion | 3400892992075 | SOLIRIS 300MG PERF FL30ML | ALEXION PHARMA FRANCE |
JORF n°0179 du 4 août 2021 Texte n° 33
Arrêté du 28 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit.
Libellés abrogés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 390 029 9 6 | ALVESCO 160 microgrammes/dose (ciclésonide), solution pour inhalation, 60 doses en flacon (B/1) (Laboratoires ASTRAZENECA) | 34009 390 029 9 6 | ALVESCO 160 microgrammes/dose (ciclésonide), solution pour inhalation, 60 doses en flacon (B/1) (Laboratoires COVIS PHARMA EUROPE B.V.) |
34009 390 025 3 8 | ALVESCO 80 microgrammes/dose (ciclésonide), solution pour inhalation, 60 doses en flacon (B/1) (Laboratoires ASTRAZENECA) | 34009 390 025 3 8 | ALVESCO 80 microgrammes/dose (ciclésonide), solution pour inhalation, 60 doses en flacon (B/1) (Laboratoires COVIS PHARMA EUROPE B.V.) |
34009 221 087 1 1 | BUCCOLAM 10 mg (chlorhydrate de midazolam), solution buccale, 2 ml en seringue préremplie (B/4) (Laboratoires TAKEDA FRANCE SAS) | 34009 221 087 1 1 | BUCCOLAM 10 mg (chlorhydrate de midazolam), solution buccale, 2 ml en seringue préremplie (B/4) (Laboratoires NEURAXPHARM FRANCE) |
34009 221 084 2 1 | BUCCOLAM 2,5 mg (chlorhydrate de midazolam), solution buccale, 0,5 ml en seringue préremplie (B/4) (Laboratoires TAKEDA FRANCE SAS) | 34009 221 084 2 1 | BUCCOLAM 2,5 mg (chlorhydrate de midazolam), solution buccale, 0,5 ml en seringue préremplie (B/4) (Laboratoires NEURAXPHARM FRANCE) |
34009 221 085 9 9 | BUCCOLAM 5 mg (chlorhydrate de midazolam), solution buccale, 1 ml en seringue préremplie (B/4) (Laboratoires TAKEDA FRANCE SAS) | 34009 221 085 9 9 | BUCCOLAM 5 mg (chlorhydrate de midazolam), solution buccale, 1 ml en seringue préremplie (B/4) (Laboratoires NEURAXPHARM FRANCE) |
34009 221 086 5 0 | BUCCOLAM 7,5 mg (chlorhydrate de midazolam), solution buccale, 1,5 ml en seringue préremplie (B/4) (Laboratoires TAKEDA FRANCE SAS) | 34009 221 086 5 0 | BUCCOLAM 7,5 mg (chlorhydrate de midazolam), solution buccale, 1,5 ml en seringue préremplie (B/4) (Laboratoires NEURAXPHARM FRANCE) |
34009 329 350 5 5 | CELECTOL 200 mg (chlorhydrate de céliprolol), comprimés pelliculés (B/28) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 329 350 5 5 | CELECTOL 200 mg (chlorhydrate de céliprolol), comprimés pelliculés (B/28) (Laboratoires CHEPLAPHARM FRANCE) |
34009 372 393 4 9 | CELECTOL 200 mg (chlorhydrate de céliprolol), comprimés pelliculés (B/84) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 372 393 4 9 | CELECTOL 200 mg (chlorhydrate de céliprolol), comprimés pelliculés (B/84) (Laboratoires CHEPLAPHARM FRANCE) |
34009 216 536 6 3 | DOXAZOSINE MYLAN LP 4 mg, comprimés à libération prolongée (B/28) (Laboratoires SUBSTIPHARM) | 34009 216 536 6 3 | DOXAZOSINE SUBSTIPHARM LP 4 mg, comprimés à libération prolongée (B/28) (Laboratoires SUBSTIPHARM) |
34009 216 567 9 4 | DOXAZOSINE MYLAN LP 8 mg, comprimés à libération prolongée (B/28) (Laboratoires SUBSTIPHARM) | 34009 216 567 9 4 | DOXAZOSINE SUBSTIPHARM LP 8 mg, comprimés à libération prolongée (B/28) (Laboratoires SUBSTIPHARM) |
34009 278 146 7 9 | ESOMEPRAZOLE ARISTO 20 mg, gélules gastro-résistantes en flacon (B/14) (Laboratoires ARISTO PHARMA GMBH) | 34009 278 146 7 9 | ESOMEPRAZOLE EVOLUGEN PHARMA 20 mg, gélules gastro-résistantes en flacon (B/14) (Laboratoires EVOLUPHARM) |
34009 278 150 4 1 | ESOMEPRAZOLE ARISTO 40 mg, gélules gastro-résistantes en flacon (B/14) (Laboratoires ARISTO PHARMA GMBH) | 34009 278 150 4 1 | ESOMEPRAZOLE EVOLUGEN PHARMA 40 mg, gélules gastro-résistantes en flacon (B/14) (Laboratoires EVOLUPHARM) |
34009 311 576 1 8 | EXACYL 0,5 g/5 ml (acide tranexamique), solution injectable IV, 5 ml en ampoule (B/5) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 311 576 1 8 | EXACYL 0,5 g/5 ml (acide tranexamique), solution injectable IV, 5 ml en ampoule (B/5) (Laboratoires CHEPLAPHARM FRANCE) |
34009 311 575 5 7 | EXACYL 1 g/10 ml (acide tranexamique), solution buvable, 10 ml en ampoule (B/5) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 311 575 5 7 | EXACYL 1 g/10 ml (acide tranexamique), solution buvable, 10 ml en ampoule (B/5) (Laboratoires CHEPLAPHARM FRANCE) |
34009 328 555 2 0 | EXACYL 500 mg (acide tranexamique), comprimés pelliculés (B/20) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 328 555 2 0 | EXACYL 500 mg (acide tranexamique), comprimés pelliculés (B/20) (Laboratoires CHEPLAPHARM FRANCE) |
34009 304 180 9 3 | FUMAFER 66 mg, comprimés pelliculés (B/100) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 304 180 9 3 | FUMAFER 66 mg, comprimés pelliculés (B/100) (Laboratoires CHEPLAPHARM FRANCE) |
34009 559 174 4 1 | FUMAFER 66 mg, comprimés pelliculés (B/50) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 559 174 4 1 | FUMAFER 66 mg, comprimés pelliculés (B/50) (Laboratoires CHEPLAPHARM FRANCE) |
34009 325 494 2 9 | KERLONE 20 mg (bétaxolol), comprimés pelliculés sécables (B/28) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 325 494 2 9 | KERLONE 20 mg (bétaxolol), comprimés pelliculés sécables (B/28) (Laboratoires CHEPLAPHARM FRANCE) |
34009 371 464 5 6 | KERLONE 20 mg (bétaxolol), comprimés pelliculés sécables (B/84) (Laboratoires SANOFI AVENTIS FRANCE) | 34009 371 464 5 6 | KERLONE 20 mg (bétaxolol), comprimés pelliculés sécables (B/84) (Laboratoires CHEPLAPHARM FRANCE) |
JORF n°0179 du 4 août 2021 Texte n° 31
Arrêté du 28 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(15 inscriptions)
1. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté à l’exception de l’exacerbation aiguë d’une bronchite chronique.
Code CIP | Présentation |
|---|---|
34009 302 174 8 1 | BACTRIM 40 mg/mL + 8 mg/mL (sulfaméthoxazole, triméthoprime), suspension buvable en flacon (verre brun) de 100 ml + cuillère mesure (laboratoires EUMEDICA PHARMACEUTICALS GMBH) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 188 0 8 | DEXAMETHASONE MYLAN 4 mg/1 ml, solution injectable, 1 ml en ampoule (verre) (B/5) (laboratoires MYLAN SAS) |
34009 301 487 5 4 | DONASERT 52 mg (20 microgrammes/24 heures) (lévonorgestrel), dispositif intra-utérin dans une poche en polyester (B/1) (laboratoires GEDEON RICHTER FRANCE) |
34009 302 243 1 1 | DOSTINEX 0,5 mg (cabergoline), comprimés en flacon polyéthylène haute densité avec bouchon polypropylène sécurité enfant et un dessiccant (B/2) (laboratoires PFIZER) |
34009 302 243 4 2 | DOSTINEX 0,5 mg (cabergoline), comprimés en flacon polyéthylène haute densité avec bouchon polypropylène sécurité enfant et un dessiccant (B/8) (laboratoires PFIZER) |
34009 302 199 7 3 | DOTAREM 0,5 mmol/ml (acide gadotérique), solution injectable, 15 ml en seringue pré-remplie (plastique) avec nécessaire d’administration pour injecteur Medrad Spectris Solaris EP (B/1) (laboratoires GUERBET) |
34009 302 199 8 0 | DOTAREM 0,5 mmol/ml (acide gadotérique), solution injectable, 20 ml en seringue pré-remplie (plastique) avec nécessaire d’administration pour injecteur Medrad Spectris Solaris EP (B/1) (laboratoires GUERBET) |
34009 329 244 0 0 | DUPHALAC 10 g/15 ml (lactulose), solution buvable, 15 ml en sachets-dose (B/20) (laboratoires MYLAN MEDICAL SAS) |
34009 490 045 2 2 | NOZINAN 100 mg (lévomépromazine), comprimés pelliculés sécables (B/20) (laboratoires PHARMA LAB) |
34009 302 196 4 5 | PROHANCE 0,5 mmol/ml/15 ml (gadotéridol), solution injectable, 15 ml en seringue pré-remplie (verre) avec nécessaire d’administration pour injecteur automatique Optistar (seringue, raccord, perforateur et cathéter) (B/1) (laboratoires BRACCO IMAGING FRANCE) |
34009 302 196 6 9 | PROHANCE 0,5 mmol/ml/17 ml (gadotéridol), solution injectable, 17 ml en seringue pré-remplie (verre) avec nécessaire d’administration pour injecteur automatique Optistar (seringue, raccord, perforateur et cathéter) (B/1) (laboratoires BRACCO IMAGING FRANCE) |
34009 300 957 0 6 | SINETRAV 40 microgrammes/ml (travoprost), collyre en solution, 2,5 ml en flacon multidose avec système de pompe (B/1) (laboratoires HORUS PHARMA) |
34009 301 821 9 2 | TALZENNA 0,25 mg (talazoparib), gélules en flacon (B/30) (laboratoires PFIZER) |
34009 301 822 0 8 | TALZENNA 1 mg (talazoparib), gélules en flacon (B/30) (laboratoires PFIZER) |
34009 268 798 1 5 | ZYCLARA 3,75% (imiquimod), crème, 250 mg en sachet (B/28) (laboratoires MYLAN MEDICAL SAS) |
DEUXIÈME PARTIE
(Extensions d’indications)
1. La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement des formes légères à modérées de la maladie de Crohn, seul ou en association avec des corticostéroïdes, chez les patients adultes réfractaires ou intolérants aux thiopurines.
Code CIP | Présentation |
|---|---|
34009 301 137 3 8 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,15 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 137 4 5 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,20 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 259 8 4 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,25 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 137 6 9 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,30 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 259 9 1 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,35 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 137 7 6 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,40 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 260 0 4 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,45 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 137 8 3 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,50 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 260 2 8 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,55 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 301 260 3 5 | METHOTREXATE ACCORD 50 mg/ml, solution injectable, 0,60 ml en seringue préremplie avec une aiguille fixée couverte d’un protège aiguille et munie d’un système de sécurité + tampon d’alcool (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
2. La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– en association, dans le traitement des crises généralisées tonico-cloniques primaires chez les adultes, les adolescents et les enfants à partir de 4 ans présentant une épilepsie généralisée idiopathique.
Code CIP | Présentation |
|---|---|
34009 224 734 8 2 | VIMPAT 100 mg (lacosamide), comprimé pelliculé, plaquettes thermoformées perforées (PVC/PVDC/Alu), boîte de 56 * 1 comprimés (conditionnement unitaire) (B/56) (laboratoires UCB PHARMA SA) |
34009 388 299 2 1 | VIMPAT 100 mg (lacosamide), comprimés pelliculés (B/56) (laboratoires UCB PHARMA SA) |
34009 221 981 4 9 | VIMPAT 10 mg/ml (lacosamide), sirop en flacon de 200 ml (B/1) (laboratoires UCB PHARMA SA) |
34009 388 309 8 9 | VIMPAT 10 mg/ml (lacosamide), solution pour perfusion en flacon (B/1) (laboratoires UCB PHARMA SA) |
34009 224 735 4 3 | VIMPAT 150 mg (lacosamide), comprimé pelliculé, plaquettes thermoformées perforées (PVC/PVDC/Alu), boîte de 56 * 1 comprimés (conditionnement unitaire) (B/56) (laboratoires UCB PHARMA SA) |
34009 388 301 7 0 | VIMPAT 150 mg (lacosamide), comprimés pelliculés (B/56) (laboratoires UCB PHARMA SA) |
34009 224 736 0 4 | VIMPAT 200 mg (lacosamide), comprimé pelliculé, plaquettes thermoformées perforées (PVC/PVDC/Alu), boîte de 56 * 1 comprimés (conditionnement unitaire) (B/56) (laboratoires UCB PHARMA SA) |
34009 388 304 6 0 | VIMPAT 200 mg (lacosamide), comprimés pelliculés (B/56) (laboratoires UCB PHARMA SA) |
34009 224 733 1 4 | VIMPAT 50 mg (lacosamide), comprimé pelliculé, plaquettes thermoformées perforées (PVC/PVDC/Alu), boîte de 56 * 1 comprimés (conditionnement unitaire) (B/56) (laboratoires UCB PHARMA SA) |
34009 388 295 7 0 | VIMPAT 50 mg (lacosamide), comprimés pelliculés (B/14) (laboratoires UCB PHARMA SA) |
34009 388 296 3 1 | VIMPAT 50 mg (lacosamide), comprimés pelliculés (B/56) (laboratoires UCB PHARMA SA) |
TROISIÈME PARTIE
(3 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit :
Libellés abrogés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 273 320 9 8 | CHAMPIX 0,5 mg et 1 mg (tartrate de varénicline), comprimés pelliculés, plaquette thermoformée (PVC/Alu) dans un étui thermocellé (B/11) à 0,5 mg + (B/14) à 1 mg (Laboratoires PFIZER) | 34009 377 180 9 7 | CHAMPIX 0,5 mg et 1 mg (tartrate de varénicline), comprimés pelliculés, plaquette thermoformée (Aclar/PVC/Alu) dans un étui thermocellé (B/11) à 0,5 mg + (B/14) à 1 mg (Laboratoires PFIZER) |
34009 273 316 1 9 | CHAMPIX 1 mg (tartrate de varénicline), comprimés pelliculés, plaquette thermoformée (PVC/Alu) dans un étui thermocellé (B/28) (Laboratoires PFIZER) | 34009 377 185 0 9 | CHAMPIX 1 mg (tartrate de varénicline), comprimés pelliculés, plaquette thermoformée (Aclar/PVC/Alu) dans un étui thermocellé (B/28) (Laboratoires PFIZER) |
34009 273 317 8 7 | CHAMPIX 1 mg (tartrate de varénicline), comprimés pelliculés, plaquette thermoformée (PVC/Alu) dans un étui thermocellé (B/56) (Laboratoires PFIZER) | 34009 377 186 7 7 | CHAMPIX 1 mg (tartrate de varénicline), comprimés pelliculés, plaquette thermoformée (Aclar/PVC/Alu) dans un étui thermocellé (B/56) (Laboratoires PFIZER) |
Les spécialités précitées dont le numéro d’identification est modifié continuent à être prises en charge pendant une période d’un an à compter de la date de publication du présent arrêté au Journal officiel. A l’issue de ce délai, l’ancien numéro d’identification est radié.
JORF n°0179 du 4 août 2021 Texte n° 26
Arrêté du 28 juin 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
(1 inscription)
La spécialité pharmaceutique rétrocédable suivante, pour laquelle la participation de l’assuré est fixée par l’Union nationale des caisses d’assurance maladie (UNCAM), est prise en charge par l’Assurance Maladie.spécialité pharmaceutique suivante.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie, pour la spécialité visée ci-dessous, sont celles qui figurent à l’autorisation de mise sur le marché à la date du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 103 4 4 | DIFICLIR 40MG/ML BUV GLE FL 1 | TILLOTTS PHARMA FRANCE S.A.S |
(1 extension d’indication)
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– traitement des infections à Clostridioides difficile (ICD), appelées également diarrhées associées à C. difficile (DACD) chez les patients pédiatriques pesant au moins 12,5 kg.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 938 437 3 4 | DIFICLIR 200 mg, comprimé pelliculé | TILLOTTS PHARMA FRANCE S.A.S |
JORF n°0179 du 4 août 2021 Texte n° 25
Arrêté du 28 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
(1 inscription)
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 062 7 0 | DIFICLIR 40 mg/ml (fidaxomicine), granulés pour suspension buvable, flacon (verre) de 7,7g, boîte de 1 flacon (B/1) (laboratoires TILLOTTS PHARMA FRANCE SAS) |
(2 extensions d’indication)
La prise en charge des spécialités ci-dessous est étendue dans l’indication suivante :
– traitement des infections à Clostridioides difficile (ICD), appelées également diarrhées associées à C. difficile (DACD) chez les patients pédiatriques pesant au moins 12,5 kg.
Code CIP | Présentation |
|---|---|
34009 582 403 6 2 | DIFICLIR 200 mg, comprimé pelliculé, plaquette thermoformée (alu/alu) – Boîte de 10 × 10 comprimés (B/100) (laboratoires TILLOTTS PHARMA FRANCE S.A.S.) |
34009 222 376 7 1 | DIFICLIR 200 mg, comprimé pelliculé, plaquette thermoformée (alu/alu) – Boîte de 2 × 10 comprimés (B/20) (laboratoires TILLOTTS PHARMA FRANCE SAS) |
JORF n°0179 du 4 août 2021 Texte n° 24
Arrêté du 28 mai 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie et à la suppression de la participation de l’assuré sont celles qui figurent dans l’autorisation de mise sur le marché à la date de la publication du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 111 0 5 | PEMETREXED HPI 25MG/ML FL20ML | PFIZER |
| 34008 900 111 2 9 | PEMETREXED HPI 25MG/ML FL40ML | PFIZER |
| 34008 900 111 1 2 | PEMETREXED HPI 25MG/ML FL4ML | PFIZER |
JORF n°0179 du 4 août 2021 Texte n° 23
Arrêté du 28 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 232 6 0 | PEMETREXED HOSPIRA 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 20 ml (B/1) (laboratoires PFIZER) |
34009 302 232 7 7 | PEMETREXED HOSPIRA 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 40 ml (B/1) (laboratoires PFIZER) |
34009 302 232 5 3 | PEMETREXED HOSPIRA 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 4 ml (B/1) (laboratoires PFIZER) |
JORF n°0179 du 4 août 2021 Texte n° 22
Arrêté du 28 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– en association au paclitaxel, est indiqué en traitement de première ligne chez les patients adultes atteints de cancer du sein métastatique ;
– en association à une chimiothérapie à base de fluoropyrimidine, est indiqué chez les patients adultes atteints de cancer colorectal métastatique ;
– en association à la capécitabine, est indiqué en traitement de première ligne, chez les patients adultes atteints de cancer du sein métastatique, pour lesquels un traitement avec d’autres options de chimiothérapie incluant des taxanes ou des anthracyclines, n’est pas considéré comme approprié. Les patients ayant reçu un traitement à base de taxanes et d’anthracyclines en situation adjuvante au cours des 12 derniers mois doivent être exclus d’un traitement par Alymsys en association à la capécitabine ;
– en association à une chimiothérapie à base de sels de platine, est indiqué en traitement de première ligne chez les patients adultes atteints de cancer bronchique non à petites cellules, avancé et non opérable, métastatique ou en rechute, dès lors que l’histologie n’est pas à prédominance épidermoïde ;
– en association à l’interféron alfa-2a, est indiqué en traitement de première ligne, chez les patients adultes atteints de cancer du rein avancé et/ou métastatique ;
– en association au carboplatine et au paclitaxel, est indiqué en traitement de première ligne des stades avancés (stades figo [fédération internationale de gynécologie obstétrique] iii b, iii c et iv) du cancer épithélial de l’ovaire, des trompes de fallope ou péritonéal primitif chez des patientes adultes ;
– en association au carboplatine et à la gemcitabine ou en association au carboplatine et au paclitaxel, est indiqué chez les patientes adultes atteintes d’un cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif, en première récidive, sensible aux sels de platine et qui n’ont pas été préalablement traitées par du bevacizumab ou d’autres inhibiteurs du VEGF (Vascular Endothelial Growth Factor) ou d’autres agents ciblant le récepteur du VEGF ;
– en association au topotécan ou à la doxorubicine liposomale pégylée, est indiqué chez les patientes adultes atteintes d’un cancer épithélial de l’ovaire, des trompes de fallope ou péritonéal primitif, en rechute, résistant aux sels de platine, qui n’ont pas reçu plus de deux protocoles antérieurs de chimiothérapie et qui n’ont pas été préalablement traitées par du bevacizumab ou d’autres inhibiteurs du vegf ou d’autres agents ciblant le récepteur du vegf ;
– en association au paclitaxel et au cisplatine, ou bien en association au paclitaxel et au topotécan chez les patientes ne pouvant pas recevoir de traitement à base de sels de platine, est indiqué chez les patientes adultes atteintes d’un carcinome du col de l’utérus persistant, en rechute ou métastatique.
Code CIP | Présentation |
|---|---|
34009 550 814 1 8 | OYAVAS 25 mg/ml (bévacizumab), solution à diluer pour perfusion, flacon (verre) de 16 ml (B/1) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 550 813 9 5 | OYAVAS 25 mg/ml (bévacizumab), solution à diluer pour perfusion, flacon (verre) de 4 ml (B/1) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
JORF n°0178 du 3 août 2021 Texte n° 44
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
(9 inscriptions)
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 382 134 1 6 | AMOXICILLINE/ACIDE CLAVULANIQUE PANPHARMA 1 g/200 mg ADULTES, poudre pour solution injectable (I.V.), poudre en flacon (verre) (B/10) (laboratoires PANPHARMA) |
34009 550 827 9 8 | CLOFARABINE ARROW 1 mg/ml, solution à diluer pour perfusion, flacon de 20 mg/ml (B/1) (laboratoires ARROW GENERIQUES) |
34009 550 799 7 2 | PLACYNOX 50% / 50%, gaz médicinal comprimé, bouteille en acier de 15 litres équipée de robinets avec manodétendeur intégré avec un raccord de sortie spécifique (B/1) (laboratoires MESSER FRANCE S.A.S) |
34009 550 799 9 6 | PLACYNOX 50% / 50%, gaz médicinal comprimé, bouteille en acier de 20 litres équipée de robinets avec manodétendeur intégré avec un raccord de sortie spécifique (B/1) (laboratoires MESSER FRANCE S.A.S) |
34009 302 233 1 4 | PLACYNOX 50% / 50%, gaz médicinal comprimé, bouteille en acier de 2 litres équipée de robinets avec manodétendeur intégré avec un raccord de sortie spécifique (B/1) (laboratoires MESSER FRANCE S.A.S) |
34009 302 233 2 1 | PLACYNOX 50% / 50%, gaz médicinal comprimé, bouteille en acier de 5 litres équipée de robinets avec manodétendeur intégré avec un raccord de sortie spécifique (B/1) (laboratoires MESSER FRANCE S.A.S) |
L’indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
– interruption de grossesse pour motif médical au cours du deuxième trimestre et l’expulsion du contenu utérin en cas d’avortement incomplet, de môle hydatiforme ou de mort fœtale in utéro.
Code CIP | Présentation |
|---|---|
34009 550 796 1 3 | NALADOR 500 microgrammes, lyophilisat pour usage parentéral, boîte de 1 flacon de 2 ml (B/1) (laboratoires BAYER HEALTHCARE) |
Les indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– douleurs intenses et/ou rebelles aux antalgiques de niveau plus faible, des douleurs sévères d’origine cancéreuse, des douleurs aiguës sévères non cancéreuses (douleurs post-opératoires), et des douleurs chroniques sévères d’origine neuropathiques ;
– douleurs intenses et/ou rebelles rencontrées dans l’arthrose du genou ou de la hanche et dans la lombalgie chronique.
Code CIP | Présentation |
|---|---|
34009 301 671 6 8 | OXYCODONE KALCEKS 10 mg/mL, solution injectable / pour perfusion, 1 ml en ampoule en verre (B/5) (laboratoires MEDIPHA SANTE) |
34009 301 671 4 4 | OXYCODONE KALCEKS 50 mg/mL, solution injectable / pour perfusion, 1 ml en ampoule en verre (B/5) (laboratoires MEDIPHA SANTE) |
(2 extensions d’indication)
La prise en charge des spécialités ci-dessous est étendue chez les adultes par voie intra-veineuse :
– en prévention des douleurs liées à l’injection de propofol ;
– en prévention des douleurs post-opératoires notamment afin d’accélérer la reprise du transit intestinal après chirurgie abdominale.
Code CIP | Présentation |
|---|---|
34009 362 726 0 6 | LIDOCAINE AGUETTANT 20 mg/ml SANS CONSERVATEUR, 20 ml en flacon (verre) (B/10) (laboratoires AGUETTANT) |
34009 277 230 4 9 | LIDOCAINE AGUETTANT 20 mg/ml SANS CONSERVATEUR, solution, 10 ml en ampoule (polypropylène) (B/10) (laboratoires AGUETTANT) |
(6 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit.
Anciens libellés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 558 376 2 6 | NEUROLITE, 1 Flacon et solution tampon (1 Boîte de 15), Trousse pour la préparation de la solution de bisicate 99m Tc (Laboratoires DUPONT PHARMA S.A.) | 34009 558 376 2 6 | NEUROLITE, trousse pour la préparation radiopharmaceutique : Injection de Bicisate de Technétium (99mTc), 25 mg en flacon (verre) et 1 ml de solution tampon (B/5) (Laboratoires CIS BIO INTERNATIONAL) |
34009 558 375 6 5 | NEUROLITE, 1 Flacon et solution tampon (1 Boîte de 1), Trousse pour la préparation de la solution de bisicate 99m Tc (Laboratoires DUPONT PHARMA S.A.) | 34009 558 375 6 5 | NEUROLITE, trousse pour la préparation radiopharmaceutique : Injection de Bicisate de Technétium (99mTc), 25 mg en flacon (verre) et 1 ml de solution tampon (verre) (B/1) (Laboratoires CIS BIO INTERNATIONAL) |
34009 550 742 3 6 | TEICOPLANINE MEDIPHA SANTE 200 mg, poudre et solvant pour solution injectable / pour perfusion ou solution buvable, poudre en flacon (verre) + 3,2 mL de solvant en ampoule (verre) (B/1) (Laboratoires MEDIPHA SANTE) | 34009 550 742 3 6 | TEICOPLANINE ALTAN 200 mg, poudre et solvant pour solution injectable / pour perfusion ou solution buvable, poudre en flacon (verre) + 3,2 mL de solvant en ampoule (verre) (B/1) (Laboratoires MEDIPHA SANTE) |
34009 550 742 4 3 | TEICOPLANINE MEDIPHA SANTE 400 mg, poudre et solvant pour solution injectable / pour perfusion ou solution buvable, poudre en flacon (verre) + 3,2 mL de solvant en ampoule (verre) (B/1) (Laboratoires MEDIPHA SANTE) | 34009 550 742 4 3 | TEICOPLANINE ALTAN 400 mg, poudre et solvant pour solution injectable / pour perfusion ou solution buvable, poudre en flacon (verre) + 3,2 mL de solvant en ampoule (verre) (B/1) (Laboratoires MEDIPHA SANTE) |
34009 338 687 9 6 | VOLTARENE 0,1 % (0,3 mg/0,3 ml) (diclofénac sodique), collyre en récipient unidose de 0,3 ml (B/100) (Laboratoires CIBA VISION OPHTHALMICS) | 34009 338 687 9 6 | VOLTARENOPHTA 0,1 POUR CENT (0,3 mg/0,3 ml) (diclofénac sodique), collyre en récipient unidose de 0,3 ml (B/100) (Laboratoires THEA PHARMA) |
34009 338 686 2 8 | VOLTARENE 0,1 % (0,3 mg/0,3 ml) (diclofénac sodique), collyre en récipient unidose de 0,3 ml (B/20) (Laboratoires CIBA VISION OPHTHALMICS) | 34009 338 686 2 8 | VOLTARENOPHTA 0,1 POUR CENT (0,3 mg/0,3 ml) (diclofénac sodique), collyre en récipient unidose de 0,3 ml (B/20) (Laboratoires THEA PHARMA) |
JORF n°0178 du 3 août 2021 Texte n° 43
Arrêté du 30 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
(6 inscriptions)
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 275 003 0 5 | ATOVAQUONE / PROGUANIL TEVA 62,5 mg/25 mg ENFANTS, comprimé pelliculé, comprimés sous plaquettes (PVC/Aluminium) (B/12) (laboratoires TEVA SANTE) |
34009 302 054 4 0 | CEFEPIME ACCORD 1 g, poudre pour solution injectable/pour perfusion (IM/IV), 1 g de poudre en flacon (verre) (B/10) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 055 8 7 | CEFEPIME ACCORD 2 g, poudre pour solution injectable/pour perfusion (IV), 2 g de poudre en flacon (verre) (B/10) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 550 575 5 0 | MONOXYDE D’AZOTE MESSER 800 PPM (V/V), gaz médicinal comprimé, Bouteille de 20 L en aluminium (ogive bleu-turquoise et corps blanc), munie d’un robinet à pression résiduelle en acier inoxydable (B/1) (laboratoires MESSER FRANCE S.A.S) |
34009 301 333 5 4 | PANTOPRAZOLE MYLAN 20 mg, comprimés gastro-résistants, comprimés sous films prédécoupés unitaires sans dessicant (Aluminium/Aluminium) (B/70) (laboratoires MYLAN SAS) |
34009 301 330 4 0 | PANTOPRAZOLE MYLAN 40 mg, comprimés gastro-résistants, comprimés sous films prédécoupés unitaires sans dessicant (Aluminium/Aluminium). (laboratoires MYLAN SAS) |
(8 extensions d’indication)
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– en monothérapie, pour le traitement des patients adultes atteints d’un myélome multiple en rechute et réfractaire, pour lesquels les traitements antérieurs incluaient un inhibiteur du protéasome et un agent immunomodulateur et dont la maladie a progressé lors du dernier traitement.
Code CIP | Présentation |
|---|---|
34009 302 122 0 2 | DARZALEX 1 800 mg (daratumumab), solution injectable, flacon (verre) de 15 ml (120 mg/ml) (B/1) (laboratoires JANSSEN-CILAG) |
La prise en charge des spécialités ci-dessous est étendue dans l’indication suivante :
– traitement de l’infection à coronavirus SARS-CoV-2 (COVID-19) chez les adultes et les adolescents (âgés de 12 ans et pesant plus de 40 kg) qui nécessitent une oxygénothérapie.
Code CIP | Présentation |
|---|---|
34009 302 043 6 8 | DEXAMETHASONE KRKA 4 mg/ml, solution injectable / pour perfusion, 1 ml en ampoule (verre) (B/20) (laboratoires KRKA FRANCE) |
34009 302 180 4 4 | DEXAMETHASONE MEDISOL 20 mg/5 ml, solution injectable, ampoules en verre de 5 ml (B/10) (laboratoires MEDISOL) |
34009 302 179 8 6 | DEXAMETHASONE MEDISOL 4 mg/1 ml, solution injectable, ampoules en verre de 1 ml (B/20) (laboratoires MEDISOL) |
34009 563 075 7 9 | DEXAMETHASONE MYLAN 20 mg/5 ml, solution injectable, 5 ml en ampoule (verre) (B/10) (laboratoires MYLAN SAS) |
34009 563 076 3 0 | DEXAMETHASONE MYLAN 4 mg/1 ml, solution injectable, 1 ml en ampoule (verre) (B/20) (laboratoires MYLAN SAS) |
34009 550 771 6 9 | DEXAMETHASONE PANPHARMA 20 mg/5 ml, solution injectable, 5 ml en ampoule (verre) (B/10) (laboratoires PANPHARMA) |
34009 550 771 4 5 | DEXAMETHASONE PANPHARMA 4 mg/ml, solution injectable, 1 ml en ampoule (verre) (B/10) (laboratoires PANPHARMA) |
(1 modification)
Le libellé de la spécialité pharmaceutique suivante est modifié comme suit. La spécialité précitée dont le numéro d’identification est modifié continue à être remboursée ou prise en charge pendant une période d’un an à compter de la date de publication du présent arrêté au Journal officiel. A l’issue de ce délai, l’ancien numéro d’identification est radié.
Ancien libellé | Nouveau libellé | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 550 604 0 6 | POTELIGEO 4 mg/ml (mogamulizumab), solution à diluer pour perfusion, flacon (verre) de 5 ml (B/1) (Laboratoires KYOWA KIRIN PHARMA) | 34009 302 249 6 0 | POTELIGEO 4 mg/ml (mogamulizumab), solution à diluer pour perfusion, flacon (verre) de 5 ml (B/1) (Laboratoires KYOWA KIRIN PHARMA) |
JORF n°0178 du 3 août 2021 Texte n° 41
Arrêté du 23 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement de l’hidrosadénite suppurée (HS, maladie de Verneuil) active, modérée à sévère, chez les patients adultes en cas de réponse insuffisante au traitement systémique conventionnel de l’HS.
Code CIP | Présentation |
|---|---|
34009 300 424 8 9 | HUMIRA 40 mg (adalimumab), solution injectable, 0,4 ml en seringue préremplie + tampon d’alcool (B/2) (laboratoires ABBVIE) |
34009 300 426 8 7 | HUMIRA 40 mg (adalimumab), solution injectable, en stylo prérempli + tampon d’alcool dans une plaquette thermoformée (B/2) (laboratoires ABBVIE) |
34009 301 164 9 4 | HUMIRA 80 mg (adalimumab), solution injectable, 0,8 ml en seringue préremplie + 1 tampon d’alcool (B/1) (laboratoires ABBVIE) |
34009 301 165 0 0 | HUMIRA 80 mg (adalimumab), solution injectable, 0,8 ml en stylo prérempli + 2 tampons d’alcool (B/1) (laboratoires ABBVIE) |
JORF n°0175 du 30 juillet 2021 Texte n° 37
Arrêté du 28 juillet 2021 portant renouvellement et modification des conditions d’inscription des bioprothèses valvulaires aortiques EDWARDS SAPIEN 3 implantées par voie transfémorale (système COMMANDER) et implantées par voie transapicale (système CERTITUDE) de la société EDWARDS LIFESCIENCES SAS inscrites au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0175 du 30 juillet 2021 Texte n° 33
Arrêté du 26 juillet 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 suvsisé, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 4, section 12 | 3478950, 3445286 | Systèmes d’implants cochléaires et d’implants du tronc cérébral |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel
JORF n°0175 du 30 juillet 2021 Texte n° 32
Arrêté du 26 juillet 2021 portant inscription des processeurs de son pour implant cochléaire HIRESOLUTION BIONIC EAR SKY CI M90 et NAIDA CI M90 de la société ADVANCED BIONICS SARL au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0175 du 30 juillet 2021 Texte n° 31
Arrêté du 23 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(3 inscriptions)
1. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
Psoriasis en plaques chronique sévère de l’enfant :
Traitement du psoriasis en plaques chronique sévère de l’enfant à partir de 6 ans et de l’adolescent, défini par :
– un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie,
– et une forme étendue et/ou un retentissement psychosocial important.
Code CIP | Présentation |
|---|---|
34009 300 105 9 4 | COSENTYX 150 mg (secukinumab), poudre pour solution injectable en flacon (B/1) (laboratoires NOVARTIS PHARMA SAS) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
Psoriasis en plaques chronique sévère de l’adulte
Traitement du psoriasis en plaques chronique sévère de l’adulte défini par :
– un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie,
– et une forme étendue et/ou un retentissement psychosocial important.
Psoriasis en plaques chronique sévère de l’enfant
Traitement du psoriasis en plaques chronique sévère de l’enfant à partir de 6 ans et de l’adolescent, défini par :
– un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie,
– et une forme étendue et/ou un retentissement psychosocial important.
Rhumatisme psoriasique actif
COSENTYX, seul ou en association avec le méthotrexate (MTX), est indiqué dans le traitement du rhumatisme psoriasique actif chez l’adulte lorsque la réponse aux traitements de fond antirhumatismaux (DMARD) antérieurs a été inadéquate.
Spondyloarthrites axiales (SpAax) :
– Spondylarthrite ankylosante (SA) active
Spondylarthrite ankylosante active chez l’adulte en cas de réponse inadéquate au traitement conventionnel.
– Spondyloarthrite axiale non radiographique (SpAax-nr) active
Spondyloarthrite axiale non radiographique active avec des signes objectifs d’inflammation, se traduisant par un taux élevé de protéine C-réactive (CRP) et/ou des signes visibles à l’imagerie par résonance magnétique (IRM), chez des adultes ayant répondu de manière inadéquate aux anti-inflammatoires non stéroïdiens (AINS).
Code CIP | Présentation |
|---|---|
34009 302 163 6 1 | COSENTYX 300 mg (secukinumab), solution injectable, 2 ml (150mg/ml) en seringue préremplie (B/1) (laboratoires NOVARTIS PHARMA SAS) |
34009 302 163 7 8 | COSENTYX 300 mg (secukinumab), solution injectable, 2 ml (150mg/ml) en stylo prérempli (B/1) (laboratoires NOVARTIS PHARMA SAS) |
DEUXIÈME PARTIE
(Extensions d’indications)
La prise en charge des spécialités ci-dessous est étendue aux indications suivantes :
Spondyloarthrites axiales (SpAax) :
Traitement de la spondyloarthrite axiale non radiographique active avec des signes objectifs d’inflammation chez des adultes ayant répondu de manière inadéquate aux anti-inflammatoires non stéroïdiens (AINS).
Psoriasis en plaques chronique sévère de l’enfant :
Traitement du psoriasis en plaques chronique sévère de l’enfant à partir de 6 ans et de l’adolescent, défini par :
– un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie,
– et une forme étendue et/ou un retentissement psychosocial important.
Code CIP | Présentation |
|---|---|
34009 300 106 0 0 | COSENTYX 150 mg (secukinumab), solution injectable en seringue préremplie (B/1) (laboratoires NOVARTIS PHARMA SAS) |
34009 300 106 1 7 | COSENTYX 150 mg (secukinumab), solution injectable en seringue préremplie (B/2) (laboratoires NOVARTIS PHARMA SAS) |
34009 300 106 2 4 | COSENTYX 150 mg (secukinumab), solution injectable en stylo prérempli (B/1) (laboratoires NOVARTIS PHARMA SAS) |
34009 300 106 3 1 | COSENTYX 150 mg (secukinumab), solution injectable en stylo prérempli (B/2) (laboratoires NOVARTIS PHARMA SAS) |
JORF n°0174 du 29 juillet 2021 Texte n° 37
Arrêté du 23 juillet 2021 portant renouvellement d’inscription de l’endoprothèse aortique fenêtrée ZENITH FENESTRATED de la société COOK France inscrite au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0173 du 28 juillet 2021 Texte n° 34
Arrêté du 23 juillet 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3116950, 3109520, 3152791, 3167077 | Implants vasculaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0173 du 28 juillet 2021 Texte n° 33
Arrêté du 23 juillet 2021 portant inscription des microspires à détachement contrôlé (formes simples) HYDROSOFT HELICOIDAL et HYDROFILL et des microspires à détachement contrôlé (formes complexes) HYDROSOFT 3D et HYDROFRAME de la société MICROVENTION Europe au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0173 du 28 juillet 2021 Texte n° 32
Arrêté du 23 juillet 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3192069, 3162157, 3195607, 3193608, 3111272, 3166184 | Implants vasculaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0173 du 28 juillet 2021 Texte n° 31
Arrêté du 23 juillet 2021 portant inscription de l’endoprothèse coronaire (stent) enrobée de biolimus (produit actif pharmacologiquement) BIOFREEDOM ULTRA de la société BIOSENSORS France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0173 du 28 juillet 2021 Texte n° 30
Arrêté du 22 juillet 2021 modifiant l’arrêté du 17 décembre 2004 fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 2 « Antirétroviraux », la spécialité suivante est ajoutée :
| NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
| TIVICAY 5 mg, comprimé dispersible | VIIV HEALTHCARE FRANCE | 6 495 513 3 | 9001499 | TIVICAY 5MG CPR |
JORF n°0172 du 27 juillet 2021 Texte n° 10
Arrêté du 22 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement additionnel aux corticostéroïdes par voie nasale chez les adultes présentant une polypose naso-sinusienne (PNS) sévère, insuffisamment contrôlés par des corticostéroïdes systémiques et par la chirurgie.
Code CIP | Présentation |
|---|---|
34009 301 166 3 0 | DUPIXENT 300 mg (dupilumab), solution injectable en seringue préremplie avec dispositif de protection d’aiguille (B/1) (laboratoires SANOFI AVENTIS FRANCE) |
34009 301 166 4 7 | DUPIXENT 300 mg (dupilumab), solution injectable en seringue préremplie avec dispositif de protection d’aiguille (B/2) (laboratoires SANOFI AVENTIS FRANCE) |
34009 301 991 9 0 | DUPIXENT 300 mg (dupilumab), solution injectable en stylo prérempli (B/2) (laboratoires SANOFI AVENTIS FRANCE) |
JORF n°0169 du 23 juillet 2021 Texte n° 28
Arrêté du 22 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– En monothérapie ou en association à la dexaméthasone, dans le traitement des patients adultes atteints de myélome multiple en progression, ayant reçu au moins 1 traitement antérieur et ayant déjà bénéficié ou étant inéligibles à une greffe de cellules souches hématopoïétiques.
– En association au melphalan et à la prednisone, est indiqué pour le traitement des patients adultes atteints de myélome multiple non traité au préalable, non éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques.
– En association à la dexaméthasone, ou à la dexaméthasone et au thalidomide, est indiqué pour le traitement d’induction des patients adultes atteints de myélome multiple non traité au préalable, éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
bortezomib | BORTEZOMIB FRESENIUS KABI 1 mg, poudre pour solution injectable | 3400890013017 | BORTEZOMIB FRK 1MG INJ FL 1 | Fresenius Kabi |
bortezomib | BORTEZOMIB FRESENIUS KABI 3,5 mg, poudre pour solution injectable | 3400890013031 | BORTEZOMIB FRK 3,5MG INJ FL 1 | Fresenius Kabi |
JORF n°0169 du 23 juillet 2021 Texte n° 23
Arrêté du 22 juin 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droites à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– en monothérapie ou en association avec la dexaméthasone, pour le traitement des patients adultes atteints de myélome multiple en progression, ayant reçu au moins 1 traitement antérieur et ayant déjà bénéficié ou étant inéligibles à une greffe de cellules souches hématopoïétiques ;
– en association avec le melphalan et la prednisone, pour le traitement des patients adultes atteints de myélome multiple non traité au préalable, non éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec la dexaméthasone, ou avec la dexaméthasone et la thalidomide, pour le traitement d’induction des patients adultes atteints de myélome multiple non traité au préalable, éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec le rituximab, le cyclophosphamide, la doxorubicine et la prednisone, pour le traitement des patients adultes atteints d’un lymphome à cellules du manteau non traité au préalable et qui ne sont pas éligibles à une greffe de cellules souches hématopoïétiques.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 130 1 7 | BORTEZOMIB FRK 1MG INJ FL 1 | FRESENIUS KABI FRANCE |
| 34008 900 130 3 1 | BORTEZOMIB FRK 3,5MG INJ FL 1 | FRESENIUS KABI FRANCE |
JORF n°0169 du 23 juillet 2021 Texte n° 22
Arrêté du 22 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– en monothérapie ou en association avec la dexaméthasone, pour le traitement des patients adultes atteints de myélome multiple en progression, ayant reçu au moins 1 traitement antérieur et ayant déjà bénéficié ou étant inéligibles à une greffe de cellules souches hématopoïétiques ;
– en association avec le melphalan et la prednisone, pour le traitement des patients adultes atteints de myélome multiple non traité au préalable, non éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec la dexaméthasone, ou avec la dexaméthasone et au thalidomide, pour le traitement d’induction des patients adultes atteints de myélome multiple non traité au préalable, éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec le rituximab, le cyclophosphamide, la doxorubicine et la prednisone, pour le traitement des patients adultes atteints d’un lymphome à cellules du manteau non traité au préalable et qui ne sont pas éligibles à une greffe de cellules souches hématopoïétiques.
Code CIP | Présentation |
|---|---|
34009 302 281 8 0 | BORTEZOMIB FRESENIUS KABI 1 mg, poudre pour solution injectable, flacon (verre) (B/1) (laboratoires FRESENIUS KABI FRANCE) |
34009 302 281 7 3 | BORTEZOMIB FRESENIUS KABI 3,5 mg, poudre pour solution injectable, flacon (verre) (B/1) (laboratoires FRESENIUS KABI FRANCE) |
JORF n°0167 du 21 juillet 2021 Texte n° 37
Arrêté du 12 juillet 2021 modifiant l’arrêté du 22 février 1990 portant exonération à la réglementation des substances vénéneuses destinées à la médecine humaine pour l’aciclovir lorsqu’il est administré par voie gingivale à la dose maximale par unité de prise de 50 mg et lorsque la quantité totale de substance active délivrée au public ne dépasse pas 100 mg
L’arrêté du 22 février 1990 susvisé est modifié comme suit :
Liste I
NOM de la substance vénéneuse | FORMES PHARMACEUTIQUES ou voies d’administration | NON DIVISÉE EN PRISES Concentration maximale % (en masse/ masse) | DIVISÉE EN PRISES Dose limite par unité de prise (en milligrammes) | QUANTITÉ MAXIMALE de substance remise au public (en milligrammes) |
|---|---|---|---|---|
Aciclovir | Voie gingivale | _ | 50 mg | 100 mg |
JORF n°0166 du 20 juillet 2021 Texte n° 29
Arrêté du 12 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
L’indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie, pour la spécialité visée ci-dessous, concerne uniquement en dernier recours pour le traitement des patients atteints d’infections à bactéries à Gram négatif multirésistantes (notamment en cas d’entérobactéries et Pseudomonas aeruginosa, avec un mécanisme de résistance de type KPC, oxacillinase ou métallo-β-lactamases [NDM, VIM, IMP]) et lorsque le recours aux autres options disponibles n’est pas envisageable.
Code CIP | Présentation |
|---|---|
34009 550 754 9 3 | FETCROJA 1g (céfidérocol), poudre pour solution à diluer pour perfusion, flacon (verre) (B/10) (laboratoires SHIONOGI BV) |
La décision d’instauration du traitement par FETCROJA (céfidérocol) devra être prise après proposition documentée issue d’une réunion de concertation thérapeutique avec un référent antibiotique, avec réévaluation systématique 48H après le début du traitement.
JORF n°0166 du 20 juillet 2021 Texte n° 28
Arrêté du 12 juillet 2021 portant radiation de spécialités pharmaceutiques de la liste des médicaments agréés à l’usage des collectivités publiques prévue à l’article L. 5123-2 du code de la santé publique
Les spécialités pharmaceutiques suivantes sont radiées de la liste des médicaments agréés à l’usage des collectivités et divers services publics. Cette radiation prend effet à l’expiration d’une période de 45 jours suivant la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 392 120 3 6 | EFIENT 10 mg (prasugrel), comprimés pelliculés (B/30 x 1) (laboratoires DAIICHI SANKYO FRANCE SAS) |
34009 397 469 4 4 | EPORATIO 10 000 UI/1 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/1) (laboratoires TEVA SANTE) |
34009 397 473 1 6 | EPORATIO 10 000 UI/1 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/6) (laboratoires TEVA SANTE) |
34009 397 458 2 4 | EPORATIO 1 000 UI/0,5 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/6) (laboratoires TEVA SANTE) |
34009 397 475 4 5 | EPORATIO 20 000 UI/1 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/1) (laboratoires TEVA SANTE) |
34009 397 477 7 4 | EPORATIO 20 000 UI/1 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/4) (laboratoires TEVA SANTE) |
34009 397 460 7 4 | EPORATIO 2 000 UI/0,5 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/6) (laboratoires TEVA SANTE) |
34009 397 482 0 7 | EPORATIO 30 000 UI/1 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/1) (laboratoires TEVA SANTE) |
34009 397 484 3 6 | EPORATIO 30 000 UI/1 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/4) (laboratoires TEVA SANTE) |
34009 397 463 6 4 | EPORATIO 3 000 UI/0,5 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/6) (laboratoires TEVA SANTE) |
34009 397 465 9 3 | EPORATIO 4 000 UI/0,5 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/6) (laboratoires TEVA SANTE) |
34009 397 467 1 5 | EPORATIO 5 000 UI/0,5 ml (époétine thêta), solution injectable en seringue préremplie sans dispositif de sécurité (B/6) (laboratoires TEVA SANTE) |
34009 554 669 5 6 | FORENE (isoflurane), solution pour inhalation, 100 ml en flacon (laboratoires ABBVIE) |
34009 554 586 2 3 | FORENE (isoflurane), solution pour inhalation, 250 ml en flacon (laboratoires ABBVIE) |
34009 329 318 4 2 | FUCIDINE 2 % (acide fusidique), crème, 15 g en tube (laboratoires LEO) |
34009 304 170 3 4 | FUCIDINE 2 % (fusidate de sodium), pommade, 15 g en tube (laboratoires LEO) |
34009 354 266 4 2 | GLUCOSE 5 % LAVOISIER, solution pour perfusion, 1 000 ml en poche suremballée (B/1) (laboratoires CHAIX ET DU MARAIS) |
34009 354 255 2 2 | GLUCOSE 5 % LAVOISIER, solution pour perfusion, 100 ml en poche suremballée (B/1) (laboratoires CHAIX ET DU MARAIS) |
34009 354 258 1 2 | GLUCOSE 5 % LAVOISIER, solution pour perfusion, 250 ml en poche suremballée (B/1) (laboratoires CHAIX ET DU MARAIS) |
34009 354 262 9 1 | GLUCOSE 5 % LAVOISIER, solution pour perfusion, 500 ml en poche suremballée (B/1) (laboratoires CHAIX ET DU MARAIS) |
34009 354 251 7 1 | GLUCOSE 5 % LAVOISIER, solution pour perfusion, 50 ml en poche suremballée (B/1) (laboratoires CHAIX ET DU MARAIS) |
34009 418 517 2 8 | HUMIRA 40 mg/0,8 ml (adalimumab), solution injectable pour usage pédiatrique, 1 étui de 2 boites (1 flacon de 0,8 ml + 1 seringue + 1 aiguille + 1 adaptateur + 2 tampons d’alcool) (laboratoires ABBVIE) |
34009 338 553 2 1 | SKELID 200 mg (tiludronate disodique), comprimés (B/28) (laboratoires H.A.C. PHARMA) |
34009 352 155 0 5 | SYNAGIS 100 mg (palivizumab), poudre et solvant pour solution injectable (B/1) (laboratoires ASTRAZENECA) |
34009 352 314 1 3 | SYNAGIS 50 mg (palivizumab), poudre et solvant pour solution injectable (B/1) (laboratoires ASTRAZENECA) |
JORF n°0166 du 20 juillet 2021 Texte n° 26
Arrêté du 12 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– Traitement des candidoses invasives chez les patients non neutropéniques âgés de 1 mois à 18 ans.
Code CIP | Présentation |
|---|---|
34009 395 983 2 1 | ECALTA 100 mg (anidulafungine), poudre pour solution à diluer pour perfusion en flacon (verre) de 30 ml (B/1) (laboratoires PFIZER) |
JORF n°0166 du 20 juillet 2021 Texte n° 25
Arrêté du 12 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(24 inscriptions)
1. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– traitement curatif de l’anémie par carence martiale,
– traitement préventif de la carence martiale de la femme enceinte uniquement chez les femmes identifiées à risque d’anémie ferriprive (notamment antécédents d’anémie, saignements récents, femmes multipares, grossesses rapprochées).
Code CIP | Présentation |
|---|---|
34009 302 219 0 7 | TARDYFERON 80 mg (sulfate ferreux), comprimés pelliculés sous plaquettes (PVC/PVDC/Aluminium) (B/90) (laboratoires PIERRE FABRE MEDICAMENT) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 088 7 8 | ENERZAIR BREEZHALER 114 microgrammes/46 microgrammes/136 microgrammes (indacatérol, glycopyrronium, mométasone), poudre pour inhalation, gélules en plaquette unitaire (B/10) + 1 inhalateur (laboratoires NOVARTIS PHARMA SAS) |
34009 302 088 9 2 | ENERZAIR BREEZHALER 114 microgrammes/46 microgrammes/136 microgrammes (indacatérol, glycopyrronium, mométasone), poudre pour inhalation, gélules en plaquette unitaire (B/30) + 1 inhalateur (laboratoires NOVARTIS PHARMA SAS) |
34009 302 089 0 8 | ENERZAIR BREEZHALER 114 microgrammes/46 microgrammes/136 microgrammes (indacatérol, glycopyrronium, mométasone), poudre pour inhalation, gélules en plaquette unitaire (B/30) + 1 inhalateur + 1 capteur (laboratoires NOVARTIS PHARMA SAS) |
34009 300 749 9 2 | ENSTILAR 50 microgrammes/0,5 mg/g (calcipotriol, bétaméthasone), mousse cutanée, 60g en flacon pressurisé (B/2) (laboratoires LEO PHARMA) |
34009 302 119 6 0 | GHEMAXAN 10 000 UI (100 mg)/1 ml (énoxaparine sodique), solution injectable, 1 ml en seringue préremplie en verre avec protège aiguilles (B/10) (laboratoires EFFIK) |
34009 302 117 7 9 | GHEMAXAN 2 000 UI (20 mg)/0,2 L (énoxaparine sodique), solution injectable, 0,2 ml en seringue préremplie en verre avec protège aiguilles (B/2) (laboratoires EFFIK) |
34009 302 117 9 3 | GHEMAXAN 2 000 UI (20 mg)/0,2 L (énoxaparine sodique), solution injectable, 0,2 ml en seringue préremplie en verre avec protège aiguilles (B/6) (laboratoires EFFIK) |
34009 302 118 2 3 | GHEMAXAN 4 000 UI (40 mg) /0,4 L (énoxaparine sodique), solution injectable, 0,4 ml en seringue préremplie en verre avec protège aiguilles (B/2) (laboratoires EFFIK) |
34009 302 118 3 0 | GHEMAXAN 4 000 UI (40 mg) /0,4 L (énoxaparine sodique), solution injectable, 0,4 ml en seringue préremplie en verre avec protège aiguilles (B/6) (laboratoires EFFIK) |
34009 302 118 8 5 | GHEMAXAN 6 000 UI (60 mg)/0,6 L (énoxaparine sodique), solution injectable, 0,6 ml en seringue préremplie en verre avec protège aiguilles (B/10) (laboratoires EFFIK) |
34009 302 118 7 8 | GHEMAXAN 6 000 UI (60 mg) /0,6 L (énoxaparine sodique), solution injectable, 0,6 ml en seringue préremplie en verre avec protège aiguilles (B/2) (laboratoires EFFIK) |
34009 302 119 3 9 | GHEMAXAN 8 000 UI (80 mg)/0,8 L (énoxaparine sodique), solution injectable, 0,8 ml en seringue préremplie en verre avec protège aiguilles (B/10) (laboratoires EFFIK) |
34009 302 119 2 2 | GHEMAXAN 8 000 UI (80 mg) /0,8 L (énoxaparine sodique), solution injectable, 0,8 ml en seringue préremplie en verre avec protège aiguilles (B/2) (laboratoires EFFIK) |
34009 490 043 9 3 | LIPOROSA 10 mg/10 mg (rosuvastatine, ézétimibe), gélules (B/30) (laboratoires DIFARMED S.L) |
34009 490 044 0 9 | LIPOROSA 10 mg/10 mg (rosuvastatine, ézétimibe), gélules (B/90) (laboratoires DIFARMED S.L) |
34009 490 044 1 6 | LIPOROSA 20 mg/10 mg (rosuvastatine, ézétimibe), gélules (B/30) (laboratoires DIFARMED S.L) |
34009 490 044 2 3 | LIPOROSA 20 mg/10 mg (rosuvastatine, ézétimibe), gélules (B/90) (laboratoires DIFARMED S.L) |
34009 490 044 5 4 | NATRIXAM 1,5 mg/10 mg (indapamide, amlodipine), comprimés à libération modifiée en plaquette PVC-Aluminium (B/30) (laboratoires DIFARMED S.L) |
34009 490 044 6 1 | NATRIXAM 1,5 mg/10 mg (indapamide, amlodipine), comprimés à libération modifiée en plaquette PVC-Aluminium (B/90) (laboratoires DIFARMED S.L) |
34009 490 044 3 0 | NATRIXAM 1,5 mg/5 mg (indapamide, amlodipine), comprimés à libération modifiée en plaquette PVC-Aluminium (B/30) (laboratoires DIFARMED S.L) |
34009 490 044 4 7 | NATRIXAM 1,5 mg/5 mg (indapamide, amlodipine), comprimés à libération modifiée en plaquette PVC-Aluminium (B/90) (laboratoires DIFARMED S.L) |
34009 269 079 9 0 | XENETIX 300 (iobitridol), solution injectable (300 mg d’iode/ml), 20 ml en flacon (B/1) (laboratoires GUERBET) |
34009 269 083 6 2 | XENETIX 350 (iobitridol), solution injectable (350 mg d’iode/ml), 20 ml en flacon (B/1) (laboratoires GUERBET) |
DEUXIÈME PARTIE
(Extension d’indication)
La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement de patients adultes atteints d’ulcères buccaux associés à la Maladie de Behçet (MB) uniquement lorsque la colchicine est contre-indiquée, inefficace ou mal tolérée.
Code CIP | Présentation |
|---|---|
34009 300 088 8 1 | OTEZLA 10 mg, OTEZLA 20 mg, OTEZLA 30 mg (aprémilast), comprimés pelliculés, (Boite de 4 comprimés de 10 mg + 4 comprimés de 20 mg + 19 comprimés de 30 mg) (laboratoires AMGEN SAS) |
34009 300 088 9 8 | OTEZLA 30 mg (apremilast), comprimés pelliculés (B/56) (laboratoires AMGEN SAS) |
JORF n°0166 du 20 juillet 2021 Texte n° 23
Arrêté du 12 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La spécialité suivante est inscrite sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
L’indication thérapeutique ouvrant droit à la prise en charge en sus par l’assurance maladie est, pour la spécialité visée ci-dessous :
– en dernier recours pour le traitement des patients atteints d’infections à bactéries à Gram négatif multirésistantes (notamment en cas d’entérobactéries et Pseudomonas aeruginosa, avec un mécanisme de résistance de type KPC, oxacillinase ou métallo-β-lactamases [NDM, VIM, IMP]) et lorsque le recours aux autres options disponibles n’est pas envisageable.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisationde mise sur le marché |
|---|---|---|---|---|
céfidérocol | FETCROJA 1 g, poudre pour solution à diluer pour perfusion | 3400890002554 | FETCROJA 1G PERF FL | SHIONOGI SAS |
JORF n°0163 du 16 juillet 2021-Texte n° 51
Arrêté du 12 juillet 2021 relatif à l’arrêt de la prise en charge précoce de spécialités pharmaceutiques au titre de l’article L. 162-16-5-1 du code de la sécurité sociale . A compter du 31 juillet 2021, il est mis fin à la prise en charge précoce de la spécialité pharmaceutique mentionnée ci-dessous :
Spécialité | Indication thérapeutique | Code UCD 7 | Libellé de l’UCD | Laboratoire exploitant |
|
|
|
|
|
JORF n°0163 du 16 juillet 2021-Texte n° 48
Arrêté du 9 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
« Dans l’annexe de l’arrêté du 5 mai 2021 susmentionné relatif à la spécialité HYQVIA®, chacune des occurrences des mots : « l’enfant et l’adolescent (âgé de 0 à 18 ans) » sont supprimées. »
JORF n°0163 du 16 juillet 2021-Texte n° 47
Arrêté du 9 juillet 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Le tableau figurant en annexe de l’arrêté du 30 juin 2021 susmentionné est remplacé par le tableau ci-dessous :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
JORF n°0163 du 16 juillet 2021-Texte n° 46
Arrêté du 9 juillet 2021 portant radiation de la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
A compter du 1er août 2021, les spécialités ci-dessous sont radiées de la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale, pour l’ensemble de leurs indications
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
JORF n°0163 du 16 juillet 2021 Texte n° 45
Arrêté du 9 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
1. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté à l’exception des surinfections de bronchites aiguës.
| Code CIP | Présentation |
|---|---|
| 34009 302 199 1 1 | AMOXICILLINE EG LABO 500 mg, gélules sous plaquette PVC/ET/PVDC/Aluminium (B/12) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
2. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics ; cette prise en charge s’applique uniquement aux assurés sociaux de Guyane.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
– traitement prophylactique du paludisme des sujets assurés sociaux de Guyane non résidents des zones impaludées et effectuant un séjour unique ou occasionnel inférieur à 3 mois en zone d’endémie palustre guyanaise.
| Code CIP | Présentation |
|---|---|
| 34009 275 004 7 3 | ATOVAQUONE/PROGUANIL TEVA 250 mg/100 mg, comprimés pelliculés (B/12) (laboratoires TEVA SANTE) |
3. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
| Code CIP | Présentation |
|---|---|
| 34009 302 025 8 6 | HYDROXYZINE BLUEFISH 25 mg, comprimés pelliculés (B/30) (laboratoires BLUEFISH PHARMACEUTICALS AB) |
| 34009 302 215 3 2 | SIMVASTATINE MYLAN 10 mg, comprimés pelliculés en flacon (B/28) (laboratoires MYLAN SAS) |
| 34009 302 022 9 6 | OXOMEMAZINE CRISTERS 0,33 mg/ml, sirop, 150 ml en flacon (verre brun) avec gobelet doseur (polypropylène) (laboratoires CRISTERS) |
JORF n°0163 du 16 juillet 2021 Texte n° 42
Arrêté du 8 juillet 2021 portant modification des conditions d’inscription de l’endoprothèse coronaire (stent) enrobée de sirolimus (produit actif pharmacologiquement) COROFLEX ISAR NEO de la société B.BRAUN MEDICAL inscrite au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0163 du 16 juillet 2021 Texte n° 41
Arrêté du 8 juillet 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3185158 | Implants vasculaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0163 du 16 juillet 2021 -Texte n° 40
Arrêté du 8 juillet 2021 portant inscription de l’implant pour fermeture du foramen ovale perméable FIGULLA FLEX II PFO de la société OCCLUTECH France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Avis relatif à la tarification de l’implant pour fermeture du foramen ovale perméable FIGULLA FLEX II PFO visé à l’article L. 165-1 du code de la sécurité sociale – JORF n°0163 du 16 juillet 2021-Texte n° 198
En application de la convention entre le comité économique des produits de santé et la société OCCLUTECH France, le tarif et le prix limite de vente (PLV) au public en euros TTC du produit visé dans le tableau ci-dessous sont fixés comme suit :
CODE | DÉSIGNATION | TARIF en € TTC | PLV en € TTC |
3185158 | Implant exovasculaire, fermeture PFO, OCCLUTECH, FIGULLA FLEX II PFO. | 3 735,00 | 3 735,00 |
JORF n°0157 du 8 juillet 2021 Texte n° 16
Arrêté du 6 juillet 2021 complétant l’arrêté du 8 décembre 2020 relatif à la procédure d’accord préalable pour bénéficier de la prise en charge de la spécialité PRALUENT® (alirocumab)
Le tableau fixant la liste des spécialités à base d’alirocumab (PRALUENT®), constituant l’annexe 1 à l’arrêté du 8 décembre 2020 susvisé, est complété par la ligne suivante :
«
34009 302 156 1 6 | PRALUENT 300 mg (alirocumab), solution injectable, 2 ml (150 mg/ml) en stylo prérempli sans bouton d’activation (B/1) (laboratoires SANOFI AVENTIS FRANCE) |
».
Le présent arrêté prend effet à compter du quatrième jour suivant la date de sa publication au Journal officiel.
JORF n°0157 du 8 juillet 2021 Texte n° 15
Arrêté du 6 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– en association à un traitement hypolipémiant optimisé chez les patients adultes ayant une hypercholestérolémie familiale hétérozygote, insuffisamment contrôlée et nécessitant un traitement par LDL-aphérèse ;
– en association à un traitement hypolipémiant optimisé chez les patients adultes ayant une maladie cardiovasculaire athéroscléreuse établie par un antécédent de SCA récent (prévention secondaire) et qui ne sont pas contrôlés (LDL-c ≥ 0,7 g/L) malgré un traitement hypolipémiant optimisé comprenant au moins une statine à la dose maximale tolérée.
Code CIP | Présentation |
|---|---|
34009 302 156 1 6 | PRALUENT 300 mg (alirocumab), solution injectable, 2 ml (150 mg/ml) en stylo prérempli sans bouton d’activation (B/1) (laboratoires SANOFI AVENTIS FRANCE) |
JORF n°0155 du 6 juillet 2021 Texte n° 31
Arrêté du 1er juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(53 inscriptions)
1. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 224 4 7 | ACIDE GADOTERIQUE GUERBET 0,5 mmol/ml, solution injectable, 10 ml en seringue préremplie en plastique (polypropylène) (B/1) (laboratoires GUERBET) |
34009 302 225 0 8 | ACIDE GADOTERIQUE GUERBET 0,5 mmol/ml, solution injectable, 15 ml en seringue préremplie en plastique (polypropylène) avec nécessaire d’administration pour injecteur Optistar Elite (seringue 60 ml + raccord + cathéter sécurisé 20G) (laboratoires GUERBET) |
34009 302 224 7 8 | ACIDE GADOTERIQUE GUERBET 0,5 mmol/ml, solution injectable, 15 ml en seringue préremplie en plastique (polypropylène) avec nécessaire d’administration (raccord+cathéter sécurisé 22G) (laboratoires GUERBET) |
34009 302 224 5 4 | ACIDE GADOTERIQUE GUERBET 0,5 mmol/ml, solution injectable, 15 ml en seringue préremplie en plastique (polypropylène) (B/1) (laboratoires GUERBET) |
34009 302 225 1 5 | ACIDE GADOTERIQUE GUERBET 0,5 mmol/ml, solution injectable, 20 ml en seringue préremplie en plastique (polypropylène) avec nécessaire d’administration pour injecteur Optistar Elite (seringue 60 ml + raccord + cathéter sécurisé 20G) (laboratoires GUERBET) |
34009 302 224 8 5 | ACIDE GADOTERIQUE GUERBET 0,5 mmol/ml, solution injectable, 20 ml en seringue préremplie en plastique (polypropylène) avec nécessaire d’administration (raccord + cathéter sécurisé 22G) (laboratoires GUERBET) |
34009 302 224 6 1 | ACIDE GADOTERIQUE GUERBET 0,5 mmol/ml, solution injectable, 20 ml en seringue préremplie en plastique (polypropylène)(B/1) (laboratoires GUERBET) |
34009 302 037 3 6 | ACIDE URSODESOXYCHOLIQUE MYLAN 500 mg, comprimés pelliculés sécables (B/60) (laboratoires MYLAN SAS) |
34009 302 034 7 7 | AMLODIPINE/VALSARTAN ZYDUS 10 mg/160 mg, comprimés pelliculés sous plaquettes (OPA/Aluminium/PVC/Aluminium) (B/90) (laboratoires ZYDUS FRANCE) |
34009 302 034 0 8 | AMLODIPINE/VALSARTAN ZYDUS 10 mg/160 mg, comprimés pelliculés sous plaquettes (PVC/Aclar/Aluminium) (B/30) (laboratoires ZYDUS FRANCE) |
34009 302 034 2 2 | AMLODIPINE/VALSARTAN ZYDUS 10 mg/160 mg, comprimés pelliculés sous plaquettes (PVC/Aclar/Aluminium) (B/90) (laboratoires ZYDUS FRANCE) |
34009 302 033 5 4 | AMLODIPINE/VALSARTAN ZYDUS 5 mg/160 mg, comprimés pelliculés sous plaquettes (OPA/Aluminium/PVC/Aluminium) (B/30) (laboratoires ZYDUS FRANCE) |
34009 302 033 7 8 | AMLODIPINE/VALSARTAN ZYDUS 5 mg/160 mg, comprimés pelliculés sous plaquettes (OPA/Aluminium/PVC/Aluminium) (B/90) (laboratoires ZYDUS FRANCE) |
34009 302 033 1 6 | AMLODIPINE/VALSARTAN ZYDUS 5 mg/160 mg, comprimés pelliculés sous plaquettes (PVC/Aclar/Aluminium) (B/30) (laboratoires ZYDUS FRANCE) |
34009 302 033 3 0 | AMLODIPINE/VALSARTAN ZYDUS 5 mg/160 mg, comprimés pelliculés sous plaquettes (PVC/Aclar/Aluminium) (B/90) (laboratoires ZYDUS FRANCE) |
34009 302 032 7 9 | AMLODIPINE/VALSARTAN ZYDUS 5 mg/80 mg, comprimés pelliculés sous plaquettes (OPA/Aluminium/PVC/Aluminium) (B/30) (laboratoires ZYDUS FRANCE) |
34009 302 032 9 3 | AMLODIPINE/VALSARTAN ZYDUS 5 mg/80 mg, comprimés pelliculés sous plaquettes (OPA/Aluminium/PVC/Aluminium) (B/90) (laboratoires ZYDUS FRANCE) |
34009 302 032 3 1 | AMLODIPINE/VALSARTAN ZYDUS 5 mg/80 mg, comprimés pelliculés sous plaquettes (PVC/Aclar/Aluminium) (B/30) (laboratoires ZYDUS FRANCE) |
34009 302 032 5 5 | AMLODIPINE/VALSARTAN ZYDUS 5 mg/80 mg, comprimés pelliculés sous plaquettes (PVC/Aclar/Aluminium) (B/90) (laboratoires ZYDUS FRANCE) |
34009 300 022 9 2 | AMOROLFINE RANBAXY 5 %, vernis à ongles médicamenteux, 2,5 ml en flacon (verre type III) avec 10 spatules (B/1) (laboratoires SUBSTIPHARM) |
34009 302 274 4 2 | BISOPROLOL REF 10 mg, comprimés pelliculés sécables (B/30) (laboratoires BIOGARAN) |
34009 302 274 5 9 | BISOPROLOL REF 10 mg, comprimés pelliculés sécables (B/90) (laboratoires BIOGARAN) |
34009 302 273 0 5 | BISOPROLOL REF 1,25 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 302 273 1 2 | BISOPROLOL REF 1,25 mg, comprimés pelliculés (B/90) (laboratoires BIOGARAN) |
34009 302 273 3 6 | BISOPROLOL REF 2,5 mg, comprimés pelliculés sécables (B/30) (laboratoires BIOGARAN) |
34009 302 273 4 3 | BISOPROLOL REF 2,5 mg, comprimés pelliculés sécables (B/90) (laboratoires BIOGARAN) |
34009 302 273 6 7 | BISOPROLOL REF 3,75 mg, comprimés pelliculés sécables (B/30) (laboratoires BIOGARAN) |
34009 302 273 9 8 | BISOPROLOL REF 5 mg, comprimés pelliculés sécables (B/30) (laboratoires BIOGARAN) |
34009 302 274 0 4 | BISOPROLOL REF 5 mg, comprimés pelliculés sécables (B/90) (laboratoires BIOGARAN) |
34009 302 274 2 8 | BISOPROLOL REF 7,5 mg, comprimés pelliculés sécables (B/30) (laboratoires BIOGARAN) |
34009 273 699 8 8 | CLOXACILLINE MYLAN 500 mg, gélules (B/16) (laboratoires MYLAN SAS) |
34009 302 271 2 1 | ENALAPRIL/LERCANIDIPINE ZENTIVA 20 mg/20 mg, comprimés pelliculés (B/30) (laboratoires ZENTIVA FRANCE) |
34009 302 271 4 5 | ENALAPRIL/LERCANIDIPINE ZENTIVA 20 mg/20 mg, comprimés pelliculés (B/90) (laboratoires ZENTIVA FRANCE) |
34009 301 173 7 8 | ENTECAVIR EVOLUGEN 0,5 mg, comprimés pelliculés (B/30) (laboratoires EVOLUPHARM) |
34009 301 173 8 5 | ENTECAVIR EVOLUGEN 1 mg, comprimés pelliculés (B/30) (laboratoires EVOLUPHARM) |
34009 301 816 8 3 | FEBUXOSTAT ZYDUS FRANCE 120 mg, comprimés pelliculés sous plaquettes (PVC/PCTFE/Aluminium) (B/28) (laboratoires ZYDUS FRANCE) |
34009 301 817 0 6 | FEBUXOSTAT ZYDUS FRANCE 120 mg, comprimés pelliculés sous plaquettes (PVC/PE/PVDC/Aluminium) (B/28) (laboratoires ZYDUS FRANCE) |
34009 301 814 5 4 | FEBUXOSTAT ZYDUS FRANCE 80 mg, comprimés pelliculés sous plaquettes (PVC/PCTFE/Aluminium) (B/28) (laboratoires ZYDUS FRANCE) |
34009 301 814 3 0 | FEBUXOSTAT ZYDUS FRANCE 80 mg, comprimés pelliculés sous plaquettes (PVC/PE/PVDC/Aluminium) (B/28) (laboratoires ZYDUS FRANCE) |
34009 302 037 0 5 | KETOCONAZOLE TEVA 2 %, crème, 15 g en tube (B/1) (laboratoires TEVA SANTE) |
34009 279 857 4 4 | LEPTAX (Lévétiracétam) 1000 mg, comprimés pelliculés Gé (B/60) (laboratoires H.A.C. PHARMA) |
34009 279 843 3 4 | LEPTAX (Lévétiracétam) 250 mg, comprimés pelliculés Gé (B/60) (laboratoires H.A.C. PHARMA) |
34009 279 848 5 3 | LEPTAX (Lévétiracétam) 500 mg, comprimés pelliculés Gé (B/60) (laboratoires H.A.C. PHARMA) |
34009 302 283 7 1 | MIDODRINE MYLAN 2,5 mg, comprimés sous plaquettes unitaires prédécoupées (Aluminium/Aluminium) (B/30) (laboratoires MYLAN SAS) |
34009 302 283 8 8 | MIDODRINE MYLAN 2,5 mg, comprimés sous plaquettes unitaires prédécoupées (Aluminium/Aluminium) (B/90) (laboratoires MYLAN SAS) |
34009 301 498 0 5 | MIDODRINE ZENTIVA 2,5 mg, comprimés (B/30) (laboratoires ZENTIVA FRANCE) |
34009 301 498 1 2 | MIDODRINE ZENTIVA 2,5 mg, comprimés (B/90) (laboratoires ZENTIVA FRANCE) |
34009 302 267 5 9 | VALGANCICLOVIR TEVA 450 mg, comprimés pelliculés sous plaquettes prédécoupées unitaires (PVC/ACLAR/PVC/Aluminium) (B/60) (laboratoires TEVA SANTE) |
2. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté à l’exception des surinfections de bronchites aiguës.
Code CIP | Présentation |
|---|---|
34009 301 170 8 8 | AMOXICILLINE ZYDUS 1 g, comprimés dispersibles sous plaquettes (PVC/PVDC/Aluminium) (B/14) (laboratoires ZYDUS FRANCE) |
34009 301 170 7 1 | AMOXICILLINE ZYDUS 1 g, comprimés dispersibles sous plaquettes (PVC/PVDC/Aluminium) (B/6) (laboratoires ZYDUS FRANCE) |
34009 301 935 0 1 | AMOXICILLINE ZYDUS 1 g, comprimés dispersibles sous plaquettes (PVC/TE/PVDC/Aluminium) (B/14) (laboratoires ZYDUS FRANCE) |
34009 301 934 9 5 | AMOXICILLINE ZYDUS 1 g, comprimés dispersibles sous plaquettes (PVC/TE/PVDC/Aluminium) (B/6) (laboratoires ZYDUS FRANCE) |
SECONDE PARTIE
(Extensions d’indications)
La prise en charge de la spécialité ci-dessous est étendue à l’indication suivante :
– réduction de la consommation d’alcool, après échec des autres traitements médicamenteux disponibles, chez les patients adultes ayant une dépendance à l’alcool et une consommation d’alcool à risque élevé.
Code CIP | Présentation |
|---|---|
34009 367 431 9 9 | BACLOFENE ZENTIVA 10 mg, comprimés sécables sous plaquettes thermoformées (B/30) (laboratoires ZENTIVA FRANCE) |
L’indication prise en charge pour les spécialités ci-dessous est désormais :
– traitement de fond de l’asthme chez les adultes, les adolescents et les enfants lorsque les inhalateurs pressurisés ou à poudre sèche ne peuvent être utilisés ou sont inadaptés.
Code CIP | Présentation |
|---|---|
34009 362 406 6 7 | BUDESONIDE ARROW 0,5 mg/2 ml, suspension pour inhalation par nébuliseur, 2 ml en récipient unidose (B/20) (laboratoire ARROW GENERIQUES) |
34009 362 632 6 0 | BUDESONIDE ARROW 1 mg/2 ml, suspension pour inhalation par nébuliseur, 2 ml en récipient unidose (B/20) (laboratoire ARROW GENERIQUES) |
JORF n°0153 du 3 juillet 2021 Texte n° 34
Arrêté du 2 juillet 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(3 inscriptions)
1. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
KAFTRIO est indiqué en association avec l’ivacaftor 150 mg comprimés dans le traitement des patients atteints de mucoviscidose âgés de 12 ans et plus homozygotes pour la mutation F508del du gène CFTR (cystic fibrosis transmembrane conductance regulator) ou hétérozygotes pour la mutation F508del du gène CFTR et porteurs d’une mutation du gène CFTR à fonction minimale.
| Code CIP | Présentation |
|---|---|
| 34009 302 113 8 0 | KAFTRIO 75 mg/50 mg/100 mg (ivacaftor, tezacaftor, elexacaftor), comprimés pelliculés (B/56) (laboratoires VERTEX PHARMACEUTICALS (FRANCE)) |
2. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
KALYDECO comprimés est indiqué en association avec tezacaftor/ivacaftor 100 mg/150 mg comprimés, dans le traitement des adultes, des adolescents et des enfants âgés de 12 ans et plus atteints de mucoviscidose, homozygotes pour la mutation F508del ou hétérozygotes pour la mutation F508del et porteurs de l’une des mutations suivantes du gène CFTR : P67L, R117C, L206W, R352Q, A455E, D579G, 711+3A→G, S945L, S977F, R1070W, D1152H, 2789+5G→A, 3272-26A→G et 3849+10kbC→T.
KALYDECO comprimés est indiqué en association avec ivacaftor/tezacaftor/elexacaftor 75 mg/50 mg/100 mg comprimés dans le traitement des adultes et des adolescents âgés de 12 ans et plus atteints de mucoviscidose, homozygotes pour la mutation F508del du gène CFTR ou hétérozygotes pour la mutation F508del du gène CFTR avec une mutation à fonction minimale (voir rubrique 5.1 du RCP).
| Code CIP | Présentation |
|---|---|
| 34009 301 594 8 4 | KALYDECO 150 mg (ivacaftor), comprimés pelliculés (B/28) (laboratoires VERTEX PHARMACEUTICALS (FRANCE)) |
3. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
SYMKEVI est indiqué en association avec ivacaftor 150 mg comprimés, dans le traitement des patients atteints de mucoviscidose âgés de 12 ans et plus, homozygotes pour la mutation F508del ou hétérozygotes pour la mutation F508del et porteurs de l’une des mutations suivantes du gène CFTR (cystic fibrosis transmembrane conductance regulator) : P67L, R117C, L206W, R352Q, A455E, D579G, 711+3A→G, S945L, S977F, R1070W, D1152H, 2789+5G→A, 3272 26A→G et 3849+10kbC→T.
| Code CIP | Présentation |
|---|---|
| 34009 301 578 4 8 | SYMKEVI 100 mg/150 mg (tezacaftor, ivacaftor), comprimés pelliculés (B/28) (laboratoires VERTEX PHARMACEUTICALS (FRANCE)) |
DEUXIÈME PARTIE
(3 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit :
| Libellés abrogés | Nouveaux libellés | ||
|---|---|---|---|
| Code CIP | Libellé | Code CIP | Libellé |
| 34009 266 060 5 3 | KALYDECO 150 mg (ivacaftor), comprimés pelliculés (B/56) (Laboratoires VERTEX PHARMACEUTICALS (UK) LIMITED) | 34009 266 060 5 3 | KALYDECO 150 mg (ivacaftor), comprimés pelliculés (B/56) (Laboratoires VERTEX PHARMACEUTICALS (FRANCE)) |
| 34009 266 061 1 4 | KALYDECO 150 mg (ivacaftor), comprimés pelliculés sous plaquette thermoformée (B/56) (Laboratoires VERTEX PHARMACEUTICALS (UK) LIMITED) | 34009 266 061 1 4 | KALYDECO 150 mg (ivacaftor), comprimés pelliculés sous plaquette thermoformée (B/56) (Laboratoires VERTEX PHARMACEUTICALS (FRANCE)) |
| 34009 301 951 5 4 | KALYDECO 25 mg (ivacaftor), granulés en sachet (B/56) (Laboratoires VERTEX PHARMACEUTICALS (UK) LIMITED) | 34009 301 951 5 4 | KALYDECO 25 mg (ivacaftor), granulés en sachet (B/56) (Laboratoires VERTEX PHARMACEUTICALS (FRANCE)) |
JORF n°0152 du 2 juillet 2021 Texte n° 34
Arrêté du 30 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous, celle qui figure à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 195 6 0 | PLEGRIDY 125 microgrammes (peginterféron bêta-1a), solution injectable, 0,5 ml en seringue préremplie (B/2) (laboratoires BIOGEN IDEC FRANCE) |
JORF n°0152 du 2 juillet 2021 Texte n° 32
Arrêté du 30 juin 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Mésothéliome pleural malin : en association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure.
– Cancer bronchique non à petites cellules :
– en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde ;
– en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé ;
– en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
pemetrexed | PEMETREXED HOSPIRA UK LIMITED 100 mg, poudre pour solution à diluer pour perfusion | 3400894285151 | PEMETREXED PFZ 100MG PERF FL 1 | PFIZER |
pemetrexed | PEMETREXED HOSPIRA UK LIMITED 500 mg, poudre pour solution à diluer pour perfusion | 3400894285212 | PEMETREXED PFZ 500MG PERF FL 1 | PFIZER |
pemetrexed | PEMETREXED HOSPIRA UK LIMITED 1000 mg, poudre pour solution à diluer pour perfusion | 3400894285090 | PEMETREXED PFZ 1000MG PERF FL1 | PFIZER |
JORF n°0152 du 2 juillet 2021 Texte n° 28
Arrêté du 22 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 235 4 3 | PEMETREXED HOSPIRA 1 000 mg, poudre pour solution à diluer pour perfusion, flacon (verre) (B/1) (laboratoires PFIZER) |
34009 302 232 2 2 | PEMETREXED HOSPIRA 100 mg, poudre pour solution à diluer pour perfusion, flacon (verre) (B/1) (laboratoires PFIZER) |
34009 302 232 3 9 | PEMETREXED HOSPIRA 500 mg, poudre pour solution à diluer pour perfusion, flacon (verre) (B/1) (laboratoires PFIZER) |
JORF n°0152 du 2 juillet 2021 Texte n° 27
Arrêté du 22 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 180 4 4 | DEXAMETHASONE MEDISOL 20 mg/5 ml, solution injectable, ampoules en verre de 5 ml (B/10) (laboratoires MEDISOL) |
34009 302 179 8 6 | DEXAMETHASONE MEDISOL 4 mg/1 ml, solution injectable, ampoules en verre de 1 ml (B/20) (laboratoires MEDISOL) |
JORF n°0151 du 1 juillet 2021 Texte n° 37
Arrêté du 30 juin 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 5. Antifongiques, les spécialités suivantes sont ajoutées :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
MICAFUNGINE TEVA 50 mg, poudre pour solution à diluer pour perfusion | TEVA SANTE | 6 210 582 3 | 9001356 | MICAFUNGINE TVC 50MG PERF FL |
MICAFUNGINE TEVA 100 mg, poudre pour solution à diluer pour perfusion | TEVA SANTE | 6 148 453 0 | 9001355 | MICAFUNGINE TVC 100MG PERF FL |
JORF n°0151 du 1 juillet 2021 Texte n° 35
Décret n° 2021-870 du 30 juin 2021 fixant les délais mentionnés aux articles L. 5121-12 et L. 5121-12-1 du code de la santé publique et à l’article L. 162-16-5-4 du code de la sécurité sociale
JORF n°0151 du 1 juillet 2021 Texte n° 34
Décret n° 2021-869 du 30 juin 2021 relatif aux autorisations d’accès précoce et compassionnel de certains médicaments
JORF n°0149 du 29 juin 2021-Texte n° 97
Avis relatif aux prix de spécialités pharmaceutiques (rectificatif)
Dans l’avis relatif aux prix de spécialités pharmaceutiques (NOR : SSAS2117512V, texte 134), publié au Journal officiel du 10 juin 2021, pour les spécialités visées ci-dessous, la baisse de prix initialement applicable au 1er juillet 2021 est repoussée au 26 juillet 2021 :
|
|
|
|
| DUPIXENT 200 mg (dupilumab), solution injectable en seringue préremplie avec dispositif de protection d’aiguille (B/2) (laboratoires SANOFI AVENTIS FRANCE) | 1 211,54 € | 1 333,19 € |
34009 301 777 2 3 | DUPIXENT 200 mg (dupilumab), solution injectable en stylo prérempli avec dispositif de protection d’aiguille (B/2) (laboratoires SANOFI AVENTIS FRANCE) | 1 211,54 € | 1 333,19 € |
34009 301 166 3 0 | DUPIXENT 300 mg (dupilumab), solution injectable en seringue préremplie avec dispositif de protection d’aiguille (B/1) (laboratoires SANOFI AVENTIS FRANCE) | 605,77 € | 683,77 € |
34009 301 166 4 7 | DUPIXENT 300 mg (dupilumab), solution injectable en seringue préremplie avec dispositif de protection d’aiguille (B/2) (laboratoires SANOFI AVENTIS FRANCE) | 1 211,54 € | 1 333,19 € |
34009 301 991 9 0 | DUPIXENT 300 mg (dupilumab), solution injectable en stylo prérempli (B/2) (laboratoires SANOFI AVENTIS FRANCE) | 1 211,54 € | 1 333,19 € |
JORF n°0149 du 29 juin 2021 -Texte n° 14
Arrêté du 22 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Inscription sur la liste des médicaments agréés à l’usage des collectivités et divers services publics des spécialités pharmaceutiques suivantes:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
JORF n°0146 du 25 juin 2021 Texte n° 32
Arrêté du 21 juin 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 2. Antirétroviraux, la spécialité suivante est ajoutée :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
RUKOBIA 600 mg, comprimé à libération prolongée | VIIV HEALTHCARE FRANCE | 6 961 066 4 | 9001038 | RUKOBIA 600MG CPR LP |
JORF n°0146 du 25 juin 2021 Texte n° 31
Arrêté du 21 juin 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7. Anticancéreux, les spécialités suivantes sont ajoutées :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
AZACITIDINE EVER PHARMA 25 mg/mL, poudre pour suspension injectable | EVER PHARMA FRANCE | 6 018 356 3 | 9001401 | AZACITIDINE ERP 25MG/ML F100MG |
AZACITIDINE EVER PHARMA 25 mg/mL, poudre pour suspension injectable | EVER PHARMA FRANCE | 6 018 356 3 | 9001402 | AZACITIDINE ERP 25MG/ML F150MG |
JORF n°0146 du 25 juin 2021 Texte n° 30
Arrêté du 21 juin 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée pour les spécialités ci-dessous ainsi qu’il suit :
Au 4 « Antibiotiques », le libellé des spécialités pharmaceutiques suivantes est modifié :
LIBELLÉS ABROGÉS | ||||
|---|---|---|---|---|
NOM DE LA SPECIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
DIFICLIR 200 MG | ASTELLAS PHARMA SAS | 6 197 335 0 | 9384373 | DIFICLIR 200 MG CPR BT20 |
DIFICLIR 40 mg/ml, granulés pour suspension buvable | ASTELLAS PHARMA SAS | 6 262 928 8 | 9001034 | DIFICLIR 40MG/ML BUV GLE FL |
NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
NOM DE LA SPECIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
DIFICLIR 200 MG | TILLOTTS PHARMA FRANCE | 6 197 335 0 | 9384373 | DIFICLIR 200 MG CPR BT20 |
DIFICLIR 40 mg/ml, granulés pour suspension buvable | TILLOTTS PHARMA FRANCE | 6 262 928 8 | 9001034 | DIFICLIR 40MG/ML BUV GLE FL |
JORF n°0146 du 25 juin 2021 Texte n° 29
Arrêté du 17 juin 2021 relatif à la prise en charge au titre de l’article L. 165-1-1 du code de la sécurité sociale du système d’aide au diagnostic du syndrome d’apnées-hypopnées obstructives du sommeil SUNRISE
JORF n°0146 du 25 juin 2021 Texte n° 28
Arrêté du 15 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement de la maladie de Still de l’adulte (MSA) chez les patients qui ont eu une réponse inadéquate à un précédent traitement par anti-inflammatoire non stéroïdien et par corticoïdes systémiques.
ILARIS peut être utilisé en monothérapie ou en association au méthotrexate.
Code CIP | Présentation |
|---|---|
34009 397 457 6 3 | ILARIS 150 mg (canakinumab), poudre pour solution injectable en flacon (B/1) (laboratoires NOVARTIS PHARMA SAS) |
34009 300 895 1 4 | ILARIS 150 mg (canakinumab), solution injectable en flacon (laboratoires NOVARTIS PHARMA SAS) |
JORF n°0143 du 22 juin 2021 Texte n° 10
Arrêté du 15 juin 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 2, section 1, sous-section 4 | 3251085 | Prothèses cardio-vasculaires hybrides |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0143 du 22 juin 2021 Texte n° 9
Arrêté du 15 juin 2021 portant inscription de la prothèse vasculaire hybride E-VITA OPEN NEO de la société CRYOLIFE France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0140 du 18 juin 2021 Texte n° 42
Arrêté du 15 juin 2021 portant homologation de la décision n° 2021-DC-0704 de l’Autorité de sûreté nucléaire du 4 février 2021 établissant la liste des activités à finalité médicale utilisant des dispositifs médicaux émetteurs de rayonnements ionisants soumises au régime d’enregistrement et les prescriptions relatives à ces activités
JORF n°0140 du 18 juin 2021 Texte n° 41
Arrêté du 14 juin 2021 portant application d’une partie de la réglementation des stupéfiants aux médicaments à usage humain composés de midazolam, administrés par voie injectable
JORF n°0140 du 18 juin 2021 Texte n° 39
Arrêté du 14 juin 2021 relatif à la prise en charge au titre de l’article L. 165-1-1 du code de la sécurité sociale du test fonctionnel ONCOGRAMME
JORF n°0140 du 18 juin 2021 Texte n° 36
Arrêté du 8 juin 2021 modifiant l’arrêté du 24 juin 2019 précisant, conformément à l’article R. 165-87 du code de la sécurité sociale, les modalités de détention du code d’identification individuelle des produits et prestations inscrits par description générique sur la liste prévue à l’article L. 165-1 du même code
JORF n°0137 du 15 juin 2021 Texte n° 17
Arrêté du 9 juin 2021 modifiant un arrêté portant radiation de spécialités pharmaceutiques de la liste des médicaments agréés à l’usage des collectivités publiques prévue à l’article L. 5123-2 du code de la santé publique
L’arrêté susvisé du 27 mai 2021 portant radiation de spécialités pharmaceutiques de la liste des médicaments agréés à l’usage des collectivités publiques prévue à l’article L. 5123-2 du code de la santé publique, publié au Journal officiel du 1er juin 2021 (NOR : SSAS2116894A) est retiré en tant qu’il concerne les spécialités suivantes :
Code CIP | Présentation |
|---|---|
34009 375 318 3 2 | PRODINAN 160 mg (extrait sec de serenoa repens), gélules (B/180) (laboratoires THERABEL LUCIEN PHARMA) |
34009 375 315 4 2 | PRODINAN 160 mg (extrait sec de serenoa repens), gélules (B/60) (laboratoires THERABEL LUCIEN PHARMA) |
JORF n°0137 du 15 juin 2021 -Texte n° 16
Arrêté du 9 juin 2021 modifiant un arrêté portant radiation de spécialités pharmaceutiques de la liste mentionnée au premier alinéa de l’article L. 162-17 du code de la sécurité sociale : PRODINAN 160 mg – B/180 et B/60 – Therabel Lucien
JORF n°0137 du 15 juin 2021- Texte n° 14
Arrêté du 9 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics – Extension à l’indication suivante: Immunomodulation chez les adultes âgés de 18 ans et plus en cas de poussées myasthéniques aigues sévères.
JORF n°0137 du 15 juin 2021-Texte n° 15
Arrêté du 9 juin 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique –Extension de prise en charge à l’indication visée en texte n°14
Spécialités :
Code CIP | Présentation |
34009 301 696 1 2 | GAMUNEX 100 mg/ml (immunoglobuline humaine normale), solution pour perfusion, solution en flacon (verre) de 100 ml (B/1) (laboratoires GRIFOLS FRANCE) |
34009 301 695 9 9 | GAMUNEX 100 mg/ml (immunoglobuline humaine normale), solution pour perfusion, solution en flacon (verre) de 10 ml (B/1) (laboratoires GRIFOLS FRANCE) |
34009 301 696 2 9 | GAMUNEX 100 mg/ml (immunoglobuline humaine normale), solution pour perfusion, solution en flacon (verre) de 200 ml (B/1) (laboratoires GRIFOLS FRANCE) |
34009 301 696 3 6 | GAMUNEX 100 mg/ml (immunoglobuline humaine normale), solution pour perfusion, solution en flacon (verre) de 400 ml (B/1) (laboratoires GRIFOLS FRANCE) |
34009 301 696 0 5 | GAMUNEX 100 mg/ml (immunoglobuline humaine normale), solution pour perfusion, solution en flacon (verre) de 50 ml (B/1) (laboratoires GRIFOLS FRANCE) |
JORF n°0137 du 15 juin 2021 Texte n° 13
Arrêté du 9 juin 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La spécialité pharmaceutique rétrocédable suivante, pour laquelle la participation de l’assuré est fixée par l’Union nationale des caisses d’assurance maladie (UNCAM), est prise en charge par l’Assurance Maladie.
La seule indication thérapeutique ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie, pour la spécialité visée ci-dessous, est celle qui figure à l’autorisation de mise sur le marché à la date du présent arrêté.
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 943 805 7 3 | CABLIVI 10MG INJ FL+SRG +NEC | SANOFI AVENTIS FRANCE |
JORF n°0137 du 15 juin 2021- Texte n°12
Arrêté du 9 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics – Inscription des spécialités pharmaceutiques suivantes : CABLIVI 10 mg
Code CIP | Présentation |
34009 301 551 1 0 | CABLIVI 10 mg (caplacizumab), poudre et solvant pour solution injectable, poudre : flacon (verre), solvant : seringue préremplie (verre), poudre 10 mg, solvant A ml, boîte de 1 flacon de poudre, 1 seringue préremplie de solvant, 1 adaptateur pour flacon, 1 aiguille hypodermique (30G), 2 tampons imbibés d’alcool (laboratoires SANOFI AVENTIS FRANCE) |
34009 301 727 5 9 | CABLIVI 10 mg (caplacizumab), poudre et solvant pour solution injectable, poudre : flacon (verre), solvant : seringue préremplie (verre), poudre : 10 mg, solvant : 1 ml, boîte de 7 (7×1) flacons de poudre, 7 (7×1) seringues préremplies de solvant, 7 (7×1) adaptateurs de flacon, 7 (7×1) aiguilles hypodermiques, 14 (7×2) tampons (boîte multidoses) (laboratoires SANOFI AVENTIS FRANCE) |
JORF n°0137 du 15 juin 2021 Texte n° 11
Arrêté du 8 juin 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
L’arrêté susvisé du 28 mai 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché, inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique, publié au Journal officiel du 4 juin 2021 (NOR : SSAS2114965A) est retiré en tant qu’il concerne la spécialité rétrocédable suivante :
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 929 814 2 0 | REVLIMID 25 mg, gélule | CELGENE |
La spécialité pharmaceutique suivante BORTEZOMIB TEVA 3,5 mg, poudre pour solution injectable est inscrite :

- sur la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics –JORF n°0134 du 11 juin 2021 -Texte n° 26
- sur la liste mentionnée à l’article L. 162-17, deuxième alinéa, du code de la sécurité sociale (RETROCESSION) – JORF n°0134 du 11 juin 2021 – Texte n°27
- sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale –JORF n°0134 du 11 juin 2021 – Texte n°28
JORF n°0133 du 10 juin 2021 – Texte n° 26
Arrêté du 10 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics – Inscription de la spécialité QUOFENIX 300 mg (délafloxacine), poudre pour solution à diluer pour perfusion, flacon (verre) (B/10) (laboratoires MENARINI FRANCE)
JORF n°0132 du 9 juin 2021 Texte n° 38
Arrêté du 4 juin 2021 portant modification des conditions d’inscription de l’endoprothèse coronaire enrobée d’évérolimus SYNERGY de la société BOSTON SCIENTIFIC inscrite au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0131 du 8 juin 2021 Texte n° 19
Arrêté du 4 juin 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 1, section 2 | 5131630 | Systèmes de thrombo-aspiration |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0131 du 8 juin 2021 Texte n° 18
Arrêté du 4 juin 2021 portant inscription du cathéter d’accès distal utilisé dans un système de thrombo-aspiration AXS VECTA de la société STRYKER France au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0131 du 8 juin 2021 Texte n° 17
Arrêté du 4 juin 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 8 | 3155884 | Implants mammaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0131 du 8 juin 2021 Texte n° 16
Arrêté du 4 juin 2021 portant inscription de l’implant mammaire rond, lisse, prérempli de gel de silicone PERLE de la société EUROSILICONE au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0131 du 8 juin 2021 Texte n° 15
Arrêté du 4 juin 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 4, section 6 | 3441940 | Moniteurs ECG implantables |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0131 du 8 juin 2021 Texte n° 13
Arrêté du 4 juin 2021 portant inscription du moniteur cardiaque implantable avec télésurveillance BIOMONITOR IIIm de la société BIOTRONIK France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0131 du 8 juin 2021 Texte n° 11
Arrêté du 3 juin 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une recommandation temporaire d’utilisation et pris en application de l’article L. 162-17-2-1 du code de la sécurité sociale
En application de l’article L. 162-17-2-1 du code de la sécurité sociale et dans le cadre de la recommandation temporaire d’utilisation dont elle fait l’objet, la spécialité pharmaceutique mentionnée en annexe du présent arrêté est prise en charge, pour une durée de trois ans, dans l’indication mentionnée dans ladite annexe.
La spécialité pharmaceutique dans l’indication mentionnés en annexe du présent arrêté est soumise à prescription hospitalière et nécessitant une surveillance particulière pendant toute la durée du traitement.
L’entreprise exploitant la spécialité pharmaceutique figurant en annexe est tenue de mettre en place le suivi des patients selon les modalités prévues dans le protocole mentionné à l’article R. 5121-76-1 du code de la santé publique.
ANNEXE
Libellé de la spécialité pharmaceutique prise en charge et laboratoire exploitant | Indication objet de la recommandation temporaire d’utilisation |
|---|---|
NAMUSCLA 167 mg, gélule (mexilétine) – Laboratoire LUPIN EUROPE GmbH | Le traitement symptomatique des myotonies dystrophiques chez l’adulte. |
JORF n°0131 du 8 juin 2021 Texte n° 10
Arrêté du 3 juin 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous, celle qui figure à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 301 721 4 8 | NAMUSCLA 167 mg (mexilétine), gélules (B/100) (laboratoires LUPIN) |
JORF n°0128 du 4 juin 2021 Texte n° 32
Arrêté du 2 juin 2021 portant changement de distributeur et radiation d’implants mammaires MENTOR de la société PEROUSE PLASTIE inscrits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0128 du 4 juin 2021 Texte n° 28
Arrêté du 1er juin 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, le code suivant est radié :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3163346 | Implants vasculaires |
JORF n°0128 du 4 juin 2021 Texte n° 27
Arrêté du 1er juin 2021 portant radiation de produits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale, au chapitre 1er, section 1, sous-section 2, paragraphe 5 : « Stent intracrânien auto-expansible », dans la rubrique « Société JOHNSON & JOHNSON MEDICAL SAS (J&J) », le code suivant est radié :
CODE | LIBELLÉ |
|---|---|
3163346 | Stent intracrânien auto-expansible, J&J, ENTERPRISE. |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0128 du 4 juin 2021 Texte n° 25
Arrêté du 1er juin 2021 portant renouvellement et modification des conditions d’inscription et radiation de la prothèse modulaire METS et portant changement de distributeur de la société STANMORE IMPLANTS WORLDWIDE LIMITED vers la société STRYKER France inscrite au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0128 du 4 juin 2021 Texte n° 24
Arrêté du 1er juin 2021 portant renouvellement d’inscription et radiation de références des électrodes et extensions pour stimulation cérébrale profonde (SCP) LIBRA et LIBRA XP de la société ABBOTT MEDICAL France inscrites au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0128 du 4 juin 2021 Texte n° 23
Arrêté du 1er juin 2021 portant renouvellement, modification des conditions d’inscription et radiation de références du système non rechargeable double canal pour stimulation cérébrale profonde (SCP) INFINITY de la société ABBOTT MEDICAL France inscrit au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0128 du 4 juin 2021 Texte n° 22
Arrêté du 28 mai 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La prise en charge de la spécialité rétrocédable ci-dessous est étendue dans l’indication suivante :
– en association avec le rituximab pour le traitement du lymphome folliculaire (de grade 1, 2 ou 3a) préalablement traité chez les patients adultes non-réfractaires au rituximab (patients non préalablement traités par rituximab ou qui n’ont pas rechuté sous traitement incluant le rituximab ou dans les 6 mois suivant son arrêt).
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 929 811 3 0 | REVLIMID 10 mg, gélule | CELGENE |
| 34008 929 813 6 9 | REVLIMID 15 mg, gélule | CELGENE |
| 34008 940 829 2 7 | REVLIMID 20 mg, gélule | CELGENE |
| 34008 940 567 8 2 | REVLIMID 2,5 mg, gélule | CELGENE |
| 34008 929 814 2 0 | REVLIMID 25 mg, gélule | CELGENE |
| 34008 929 815 9 8 | REVLIMID 5 mg, gélule | CELGENE |
| 34008 940 830 0 9 | REVLIMID 7,5 mg, gélule | CELGENE |
JORF n°0128 du 4 juin 2021 Texte n° 21
Arrêté du 28 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– en association avec le rituximab pour le traitement du lymphome folliculaire (de grade 1, 2 ou 3a) préalablement traité chez les patients adultes non-réfractaires au rituximab (patients non préalablement traités par rituximab ou qui n’ont pas rechuté sous traitement incluant le rituximab ou dans les 6 mois suivant son arrêt).
Code CIP | Présentation |
|---|---|
34009 381 023 1 4 | REVLIMID (lénalidomide)10 mg, gélule, plaquettes thermoformée (PCTFE/PVC/aluminium) (B/21) (laboratoires CELGENE) |
34009 301 082 5 3 | REVLIMID (lénalidomide) 10 mg, gélule, plaquette thermoformée (PCTFE/PVC/aluminium) (B/7) (laboratoires CELGENE) |
34009 381 024 8 2 | REVLIMID (lénalidomide)15 mg, gélule, plaquettes thermoformée (PCTFE/PVC/aluminium) (B/21) (laboratoires CELGENE) |
34009 301 082 7 7 | REVLIMID (lénalidomide) 15 mg, gélule, plaquette thermoformée (PCTFE/PVC/aluminium) (B/7) (laboratoires CELGENE) |
34009 300 177 4 6 | REVLIMID (lénalidomide) 20 mg, gélule, plaquettes thermoformée (PCTFE/PVC/aluminium) (B/21) (laboratoires CELGENE) |
34009 275 639 2 8 | REVLIMID (lénalidomide) 2,5 mg, gélule, plaquettes thermoformée (PCTFE/PVC/aluminium) (B/21) (laboratoires CELGENE) |
34009 275 945 6 4 | REVLIMID (lénalidomide) 2,5 mg, gélule, plaquettes thermoformée (PCTFE/PVC/aluminium) (B/7) (laboratoires CELGENE) |
34009 381 022 5 3 | REVLIMID (lénalidomide) 5 mg, gélule, plaquettes thermoformée (PCTFE/PVC/aluminium) (B/21) (laboratoires CELGENE) |
34009 275 946 2 5 | REVLIMID (lénalidomide) 5 mg, gélule, plaquette thermoformée (PCTFE/PVC/aluminium) (B/7) (laboratoires CELGENE) |
34009 300 177 2 2 | REVLIMID (lénalidomide) 7,5 mg, gélule, plaquettes thermoformée (PCTFE/PVC/aluminium) (B/21) (laboratoires CELGENE) |
JORF n°0128 du 4 juin 2021 Texte n° 20
Arrêté du 25 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
ANNEXE
(31 inscriptions)
1. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– traitement du carcinome hépatocellulaire chez les patients de bon pronostic ayant une cirrhose hépatique de stade Child-Pugh A et non éligibles en première intention à un traitement chirurgical ou locorégional ou après échec de ces traitements ;
– traitement du carcinome thyroïdien progressif, localement avancé ou métastatique, différencié (cancer papillaire/folliculaire/à cellules de Hürthle), réfractaire à l’iode radioactif.
Code CIP | Présentation |
|---|---|
34009 302 094 5 5 | SORAFENIB SANDOZ 200 mg, comprimés pelliculés (B/112) (laboratoires SANDOZ) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 087 9 3 | ALGINATE DE SODIUM/BICARBONATE DE SODIUM ARROW LAB 500 mg/267 mg pour 10 ml, suspension buvable, 10 ml en sachet (B/24) (laboratoires ARROW GENERIQUES) |
34009 302 272 2 0 | CLOZAPINE ZENTIVA 100 mg, comprimés sécables (B/14) (laboratoires ZENTIVA FRANCE) |
34009 302 272 4 4 | CLOZAPINE ZENTIVA 100 mg, comprimés sécables (B/28) (laboratoires ZENTIVA FRANCE) |
34009 302 271 9 0 | CLOZAPINE ZENTIVA 25 mg, comprimés sécables (B/28) (laboratoires ZENTIVA FRANCE) |
34009 302 245 7 1 | ENALAPRIL/LERCANIDIPINE EG 20 mg/20 mg, comprimés pelliculés (B/30) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 246 0 1 | ENALAPRIL/LERCANIDIPINE EG 20 mg/20 mg, comprimés pelliculés (B/90) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 170 5 4 | FOSINOPRIL ARROW LAB 10 mg, comprimés sécables (B/90) (laboratoires ARROW GENERIQUES) |
34009 302 170 7 8 | FOSINOPRIL ARROW LAB 20 mg, comprimés (B/90) (laboratoires ARROW GENERIQUES) |
34009 302 154 1 8 | LEVETIRACETAM EG LABO 1000 mg, comprimés pelliculés sécables (B/60) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 152 9 6 | LEVETIRACETAM EG LABO 250 mg, comprimés pelliculés sécables (B/60) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 153 5 7 | LEVETIRACETAM EG LABO 500 mg, comprimés pelliculés sécables (B/60) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 302 221 3 3 | NEVIRAPINE ARROW LP 400 mg, comprimés à libération prolongée (B/30) (laboratoires ARROW GENERIQUES) |
34009 494 317 0 0 | OLANZAPINE ZENTIVA 10 mg, comprimés pelliculés sécables (B/28) (laboratoires ZENTIVA FRANCE) |
34009 494 301 7 8 | OLANZAPINE ZENTIVA 5 mg, comprimés pelliculés sécables (B/28) (laboratoires ZENTIVA FRANCE) |
34009 494 306 9 7 | OLANZAPINE ZENTIVA 7,5 mg, comprimés pelliculés (B/28) (laboratoires ZENTIVA FRANCE) |
34009 302 180 0 6 | RISPERIDONE TEVA L.P. 25 mg/2 ml, poudre et solvant pour suspension injectable à libération prolongée, 1 flacon (verre) avec adaptateur pour flacon avec aiguilles – 1 seringue préremplie (verre) de 2 ml (laboratoires TEVA SANTE) |
34009 302 180 2 0 | RISPERIDONE TEVA L.P. 37,5 mg/2 ml, poudre et solvant pour suspension injectable à libération prolongée, 1 flacon (verre) avec adaptateur pour flacon avec aiguilles – 1 seringue préremplie (verre) de 2 ml (laboratoires TEVA SANTE) |
34009 302 180 3 7 | RISPERIDONE TEVA L.P. 50 mg/2 ml, poudre et solvant pour suspension injectable à libération prolongée, 1 flacon (verre) avec adaptateur pour flacon avec aiguilles – 1 seringue préremplie (verre) de 2 ml (laboratoires TEVA SANTE) |
34009 302 267 0 4 | ROPINIROLE ARROW GENERIQUES 0,25 mg, comprimés pelliculés (B/21) (laboratoires ARROW GENERIQUES) |
34009 302 267 1 1 | ROPINIROLE ARROW GENERIQUES 0,50 mg, comprimés pelliculés (B/21) (laboratoires ARROW GENERIQUES) |
34009 302 267 2 8 | ROPINIROLE ARROW GENERIQUES 1 mg, comprimés pelliculés (B/21) (laboratoires ARROW GENERIQUES) |
34009 302 267 3 5 | ROPINIROLE ARROW GENERIQUES 2 mg, comprimés pelliculés (B/21) (laboratoires ARROW GENERIQUES) |
34009 302 101 8 5 | TELMISARTAN/AMLODIPINE ARROW 40 mg/10 mg, comprimés (B/30) (laboratoires ARROW GENERIQUES) |
34009 302 227 2 0 | TELMISARTAN/AMLODIPINE ARROW 40 mg/10 mg, comprimés (B/90) (laboratoires ARROW GENERIQUES) |
34009 302 101 7 8 | TELMISARTAN/AMLODIPINE ARROW 40 mg/5 mg, comprimés (B/30) (laboratoires ARROW GENERIQUES) |
34009 302 227 1 3 | TELMISARTAN/AMLODIPINE ARROW 40 mg/5 mg, comprimés (B/90) (laboratoires ARROW GENERIQUES) |
34009 302 102 1 5 | TELMISARTAN/AMLODIPINE ARROW 80 mg/10 mg, comprimés (B/30) (laboratoires ARROW GENERIQUES) |
34009 302 227 4 4 | TELMISARTAN/AMLODIPINE ARROW 80 mg/10 mg, comprimés (B/90) (laboratoires ARROW GENERIQUES) |
34009 302 101 9 2 | TELMISARTAN/AMLODIPINE ARROW 80 mg/5 mg, comprimés (B/30) (laboratoires ARROW GENERIQUES) |
34009 302 227 3 7 | TELMISARTAN/AMLODIPINE ARROW 80 mg/5 mg, comprimés (B/90) (laboratoires ARROW GENERIQUES) |
(Rectificatif)
Dans l’arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréés à l’usage des collectivités et divers services publics (NOR : SSAS2107740A, texte 26), publié au Journal officiel du 30 mars 2021, pour les spécialités visées ci-dessous, les indications thérapeutiques prises en charge par l’assurance maladie sont rectifiées comme suit :
Au lieu de :
« Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– traitement des patients adultes atteints de leucémie aiguë lymphoblastique (LAL Ph+) en cas de résistance ou intolérance à un traitement antérieur.
– traitement des patients pédiatriques atteints de leucémie myéloïde chronique (LMC) à chromosome Philadelphie positive (Ph+) en phase chronique, résistants ou intolérants à l’imatinib,
– traitement des patients pédiatriques atteints de leucémie aiguë lymphoblastique à Chromosome Philadelphie (LAL Ph+) nouvellement diagnostiquée en association à une chimiothérapie. »,
lire :
« Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– traitement des patients adultes atteints de leucémie aiguë lymphoblastique (LAL Ph+) en cas de résistance ou intolérance à un traitement antérieur ;
– traitement des patients pédiatriques atteints de leucémie aiguë lymphoblastique à Chromosome Philadelphie (LAL Ph+) nouvellement diagnostiquée en association à une chimiothérapie. »
Code CIP | Présentation |
|---|---|
34009 302 197 9 9 | DASATINIB BIOGARAN 100 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 302 198 2 9 | DASATINIB BIOGARAN 140 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 302 196 9 0 | DASATINIB BIOGARAN 20 mg, comprimés pelliculés (B/60) (laboratoires BIOGARAN) |
34009 302 197 3 7 | DASATINIB BIOGARAN 50 mg, comprimés pelliculés (B/60) (laboratoires BIOGARAN) |
34009 302 197 6 8 | DASATINIB BIOGARAN 70 mg, comprimés pelliculés (B/60) (laboratoires BIOGARAN) |
JORF n°0126 du 2 juin 2021 Texte n° 30
Arrêté du 31 mai 2021 portant modification des conditions d’inscription des allogreffes osseuses viro-inactivées par procédé C+TBA ALLOTEC de la société NOVOMEDICS France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0126 du 2 juin 2021 Texte n° 29
Arrêté du 31 mai 2021 portant modification des conditions d’inscription des allogreffes osseuses traitées par procédé DIZG de la société NOVOMEDICS France inscrites au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables, chapitre 3, section 1, sous-section 1, au paragraphe 1 « Greffons osseux sous forme de poudre (granulométrie < 2 mm) », dans la rubrique « Greffons osseux pour un volume supérieur ou égal à 4 cm3 (> ou = 4 cm3) », dans la rubrique « Société NOVOMEDICS France (NOVOMEDICS) », à la nomenclature du code 3378360 relatif à DIZG :
Les références prises en charge : « GT3772/DD3772 : Poudre d’os cortico spongieux 0.212-0.85 mm » sont remplacées par les références suivantes : « GT2772/DD2772 : Poudre d’os cortico-spongieux 0.212-0.85 mm ».
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0126 du 2 juin 2021 Texte n° 28
Arrêté du 31 mai 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 3, section 1 | 3317826, 3331329, 3375670, 3363418 | Greffons osseux |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0126 du 2 juin 2021 Texte n° 26
Arrêté du 31 mai 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 1, section 1 | 5180060 | Stents retrievers |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0126 du 2 juin 2021 Texte n° 25
Arrêté du 31 mai 2021 portant inscription du stent retriever 3D REVASCULARISATION DEVICE de la société PENUMBRA France au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0126 du 2 juin 2021 Texte n° 24
Arrêté du 31 mai 2021 relatif à l’arrêt de la prise en charge de spécialités pharmaceutiques au titre de l’article L. 162-16-5-2 du code de la sécurité sociale
Il est mis fin à la prise en charge des spécialités pharmaceutiques bénéficiant d’une prise en charge au titre du « post-ATU » mentionnée au I de l’article L. 162-16-5-2 du code de la sécurité sociale conformément aux dispositions qui figurent en annexe.
ANNEXE
(2 arrêts de prise en charge)
A compter du 30 juin 2021, il est mis fin à la prise en charge mentionnée au I de l’article L. 162-16-5-2 du code de la sécurité sociale de la spécialité pharmaceutique mentionnée ci-dessous :
Spécialité pharmaceutique | Indication thérapeutique | Code UCD 7 | Libellé de l’UCD | Laboratoire exploitant |
|---|---|---|---|---|
RAXONE® 150 mg comprimés pelliculés | – Le traitement des patients âgés de plus de 14 ans présentant un épisode de neuropathie optique héréditaire de Leber (NOHL) dont les symptômes ont débuté depuis plus de un an – Le traitement des patients âgés de plus de 14 ans présentant un épisode de neuropathie optique héréditaire de Leber (NOHL) dont les symptômes ont débuté depuis moins de 1 an. | 9399216 | RAXONE 150MG CPR PELLIC | SANTHERA Pharmaceuticals |
Il est mis fin à la prise en charge mentionnée au I de l’article L. 162-16-5-2 du code de la sécurité sociale de la spécialité pharmaceutique mentionnée ci-dessous :
Spécialité pharmaceutique | Indication thérapeutique | Code UCD 7 | Libellé de l’UCD | Laboratoire exploitant |
|---|---|---|---|---|
KOLBAM® 50 mg, gélule | – le traitement des anomalies congénitales de la synthèse des acides biliaires primaires dues à un déficit en stérol 27- hydroxylase (se manifestant par une xanthomatose cérébrotendineuse, XCT), en 2- (ou α-) méthylacyl-CoA racémase (AMACR) ou en cholestérol 7α-hydroxylase (CYP7A1)1, chez les nourrissons, les enfants et les adolescents âgés d’un mois à dix-huit ans et chez les adultes | 9404638 | KOLBAM 50MG GELU | RETROPHIN EUROPE LIMITED |
JORF n°0126 du 2 juin 2021 Texte n° 23
Arrêté du 31 mai 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutique ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– en association à une chimiothérapie à base de fluoropyrimidine, est indiqué chez les patients adultes atteints de cancer colorectal métastatique ;
– traitement de première ligne des patients atteints de cancer bronchique non à petites cellules, avancé et non opérable, métastatique ou en stade de rechute, dès lors que l’histologie n’est pas à prédominance épidermoïde, en association à une chimiothérapie à base de sels de platine ;
– en association au carboplatine et au paclitaxel, traitement de 1ère ligne des stades avancés (stades FIGO III B, III C et IV) du cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif chez des patientes adultes ;
– en association au carboplatine et à la gemcitabine, est indiqué chez les patientes adultes atteintes d’un cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif, en première récidive, sensible aux sels de platine et qui n’ont pas été préalablement traitées par du bevacizumab ou d’autres inhibiteurs du VEGF ou d’autres agents ciblant le récepteur du VEGF ;
– en association au topotécan ou à la doxorubicine liposomale pégylée, est indiqué chez les patientes adultes atteintes d’un cancer épithélial de l’ovaire, des trompes de Fallope ou péritonéal primitif, en rechute, résistant aux sels de platine, qui n’ont pas reçu plus de deux protocoles antérieurs de chimiothérapie et qui n’ont pas été préalablement traitées par du bevacizumab ou d’autres inhibiteurs du VEGF ou d’autres agents ciblant le récepteur du VEGF.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
bévacizumab | ALYMSYS® 25 mg/mL, solution à diluer pour perfusion | 3400890011211 | ALYMSYS 25MG/ML PERF FL4ML | ZENTIVA FRANCE |
bévacizumab | ALYMSYS® 25 mg/mL, solution à diluer pour perfusion | 3400890011204 | ALYMSYS 25MG/ML PERF FL16ML | ZENTIVA FRANCE |
JORF n°0126 du 2 juin 2021 Texte n° 22
Arrêté du 31 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
ANNEXE
PREMIÈRE PARTIE
(7 inscriptions)
1. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
– traitement de l’hépatite C chronique (HCC) chez les enfants âgés de 6 ans et plus et pesant au moins 17 kg.
Code CIP | Présentation |
|---|---|
34009 302 147 3 2 | EPCLUSA 200 mg/50 mg (sofosbuvir, velpatasvir), comprimés pelliculés en flacon (B/28) (laboratoires GILEAD SCIENCES) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– traitement de l’hépatite C chronique (HCC) chez les patients pédiatriques âgés de 3 ans à moins de 12 ans.
Code CIP | Présentation |
|---|---|
34009 302 115 3 3 | HARVONI 33,75 mg/150 (lédipasvir, sofosbuvir), granulés enrobés en sachet (B/28) (laboratoires GILEAD SCIENCES) |
34009 302 115 2 6 | HARVONI 45 mg/200 mg (lédipasvir, sofosbuvir), comprimés pelliculés en flacon (B/28) (laboratoires GILEAD SCIENCES) |
34009 302 115 4 0 | HARVONI 45 mg/200 mg (lédipasvir, sofosbuvir), granulés enrobés en sachet (B/28) (laboratoires GILEAD SCIENCES) |
34009 302 114 7 2 | SOVALDI 150 mg (sofosbuvir), granulés enrobés en sachet (B/28) (laboratoires GILEAD SCIENCES) |
34009 302 115 1 9 | SOVALDI 200 mg (sofosbuvir), comprimés pelliculés en flacon (B/28) (laboratoires GILEAD SCIENCES) |
34009 302 115 0 2 | SOVALDI 200 mg (sofosbuvir), granulés enrobés en sachet (B/28) (laboratoires GILEAD SCIENCES) |
DEUXIÈME PARTIE
(Extensions d’indications)
1. La prise en charge de la spécialité ci-dessous est étendue à l’indication suivante :
– traitement de l’hépatite C chronique (HCC) chez les enfants âgés de 6 ans et plus et pesant au moins 17 kg.
Code CIP | Présentation |
|---|---|
34009 300 673 1 4 | EPCLUSA 400 mg/100 mg (sofosbuvir, velpatasvir), comprimé pelliculé, flacon (PEHD) (B/28) (laboratoires GILEAD SCIENCES) |
2. La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement de l’hépatite C chronique (HCC) chez les patients pédiatriques âgés de 3 ans à moins de 12 ans.
Code CIP | Présentation |
|---|---|
34009 300 008 8 5 | HARVONI 90 mg/400 mg (lédipasvir, sofosbuvir), comprimés pelliculés (B/28) (laboratoires GILEAD SCIENCES) |
34009 277 070 7 0 | SOVALDI 400 mg (sofosbuvir), comprimés pelliculés (B/28) (laboratoires GILEAD SCIENCES) |
JORF n°0126 du 2 juin 2021 Texte n° 20
Arrêté du 28 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
ANNEXE
(7 inscriptions)
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 076 4 2 | AMISULPRIDE OHRE PHARMA 100 mg/ml, solution buvable, 60 ml en flacon (verre) + seringue pour administration orale (graduée tous les 0,5 ml) (B/1) (laboratoires OHRE PHARMA) |
34009 302 165 6 9 | FOLINATE DE CALCIUM ALTAN 350 mg, poudre pour solution injectable, poudre en flacon (verre) (B/1) (laboratoires MEDIPHA SANTE) |
34009 302 165 4 5 | FOLINATE DE CALCIUM ALTAN 50 mg, poudre pour solution injectable, poudre en flacon (verre) (B/1) (laboratoires MEDIPHA SANTE) |
34009 302 272 9 9 | NITISINONE DIPHARMA 10 mg, gélule, gélules en plaquettes (OPA/ALUMINIUM/PVC/ALUMINIUM) (B/60) (laboratoires ARROW GENERIQUES) |
34009 302 272 7 5 | NITISINONE DIPHARMA 20 mg, gélule, gélules en plaquettes (OPA/ALUMINIUM/PVC/ALUMINIUM) (B/60) (laboratoires ARROW GENERIQUES) |
34009 302 272 6 8 | NITISINONE DIPHARMA 2 mg, gélule, gélules en plaquettes (OPA/ALUMINIUM/PVC/ALUMINIUM) (B/60) (laboratoires ARROW GENERIQUES) |
34009 302 272 8 2 | NITISINONE DIPHARMA 5 mg, gélule, gélules en plaquettes (OPA/ALUMINIUM/PVC/ALUMINIUM) (B/60) (laboratoires ARROW GENERIQUES) |
(4 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit. Les spécialités précitées dont le numéro d’identification est modifié continuent à être remboursées ou prises en charge pendant une période d’un an à compter de la date de publication du présent arrêté au Journal officiel. A l’issue de ce délai, l’ancien numéro d’identification est radié.
Ancien libellé | Nouveau libellé | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 550 030 9 0 | OCTAPLASLG (protéines plasmatiques humaines), solution pour perfusion, 200 ml de solution en poche (PVC). Groupe sanguin A (B/10) (Laboratoires OCTAPHARMA FRANCE) | 34009 550 719 6 9 | OCTAPLASLG (protéines plasmatiques humaines), solution pour perfusion, 200 ml de solution en poche (PVC). Groupe sanguin A (B/10) (Laboratoires OCTAPHARMA FRANCE) |
34009 550 031 0 6 | OCTAPLASLG (protéines plasmatiques humaines), solution pour perfusion, 200 ml de solution en poche (PVC). Groupe sanguin AB (B/10) (Laboratoires OCTAPHARMA FRANCE) | 34009 550 719 7 6 | OCTAPLASLG (protéines plasmatiques humaines), solution pour perfusion, 200 ml de solution en poche (PVC). Groupe sanguin AB (B/10) (Laboratoires OCTAPHARMA FRANCE) |
34009 550 031 1 3 | OCTAPLASLG (protéines plasmatiques humaines), solution pour perfusion, 200 ml de solution en poche (PVC). Groupe sanguin B (B/10) (Laboratoires OCTAPHARMA FRANCE) | 34009 550 719 9 0 | OCTAPLASLG (protéines plasmatiques humaines), solution pour perfusion, 200 ml de solution en poche (PVC). Groupe sanguin B (B/10) (Laboratoires OCTAPHARMA FRANCE) |
34009 550 031 2 0 | OCTAPLASLG (protéines plasmatiques humaines), solution pour perfusion, 200 ml de solution en poche (PVC). Groupe sanguin O (B/10) (Laboratoires OCTAPHARMA FRANCE) | 34009 550 720 0 3 | OCTAPLASLG (protéines plasmatiques humaines), solution pour perfusion, 200 ml de solution en poche (PVC). Groupe sanguin O (B/10) (Laboratoires OCTAPHARMA FRANCE) |
JORF n°0126 du 2 juin 2021 Texte n° 18
Arrêté du 27 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
ANNEXE
(4 inscriptions)
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 301 500 8 5 | BRIMAZED 2 mg/ml (brimonidine), collyre en solution en récipient unidose, récipients unidoses transparents (PEBD) contenant 0,35 ml de collyre (B/60) (laboratoires HORUS PHARMA) |
34009 302 108 5 7 | PRIMOVIST 0,25 mmol/ml (gadoxétate disodique), solution injectable, 10 ml en seringue préremplie (verre) (B/1) (laboratoires BAYER HEALTHCARE) |
34009 550 744 1 0 | PRIMOVIST 0,25 mmol/ml (gadoxétate disodique), solution injectable, 10 ml en seringue préremplie (verre) (B/5) (laboratoires BAYER HEALTHCARE) |
34009 302 223 9 3 | SOLUMEDROL 500 mg (méthylprednisolone), poudre pour solution injectable, 500 mg de poudre en flacon (verre) (B/1) (laboratoires PFIZER) |
(2 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit.
Ancien libellé | Nouveau libellé | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 578 904 4 5 | TEPADINA 100 mg (thiotépa), poudre pour concentré pour perfusion, flacon (verre), 10 mg/ml (B/1) (Laboratoires KEOCYT) | 34009 578 904 4 5 | TEPADINA 100 mg (thiotépa), poudre pour concentré pour perfusion, flacon (verre), 10 mg/ml (B/1) (Laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 578 903 8 4 | TEPADINA 15 mg (thiotépa), poudre pour concentré pour perfusion, flacon (verre), 10 mg/ml (B/1) (Laboratoires KEOCYT) | 34009 578 903 8 4 | TEPADINA 15 mg (thiotépa), poudre pour concentré pour perfusion, flacon (verre), 10 mg/ml (B/1) (Laboratoires ACCORD HEALTHCARE FRANCE SAS) |
JORF n°0125 du 1 juin 2021 Texte n° 22
Arrêté du 27 mai 2021 portant radiation de spécialités pharmaceutiques de la liste des médicaments agréés à l’usage des collectivités publiques prévue à l’article L. 5123-2 du code de la santé publique
Les spécialités pharmaceutiques suivantes sont radiées de la liste des médicaments agréés à l’usage des collectivités et divers services publics. La radiation prend effet à l’expiration d’une période de 15 jours suivant la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 378 149 8 0 | ACICLOVIR BGR 200 mg, comprimés (B/25) (laboratoires BIOGARAN) |
34009 379 498 6 6 | ACICLOVIR BGR 800 mg, comprimés (B/35) (laboratoires BIOGARAN) |
34009 384 789 5 2 | ACIDE FUSIDIQUE BIOGARAN 2%, crème, 15 g en tube (B/1) (laboratoires BIOGARAN) |
34009 348 941 5 2 | ALLOPURINOL SET 100 mg, comprimés (B/28) (laboratoires BIOGARAN) |
34009 348 943 8 1 | ALLOPURINOL SET 200 mg, comprimés (B/28) (laboratoires BIOGARAN) |
34009 348 945 0 3 | ALLOPURINOL SET 300 mg, comprimés (B/28) (laboratoires BIOGARAN) |
34009 398 974 4 8 | AMOROLFINE BIOGARAN 5 %, vernis à ongles médicamenteux, 2,5 ml en flacon avec 10 spatules (laboratoires BIOGARAN) |
34009 379 547 7 8 | CEFPODOXIME BGR 100 mg, comprimés pelliculés (B/10) (laboratoires BIOGARAN) |
34009 331 217 7 8 | CEFUROXIME BIOGARAN 125 mg, comprimés pelliculés (B/8) (laboratoires BIOGARAN) |
34009 354 052 4 1 | DILTIAZEM BIOGARAN LP 300 mg, gélule à libération prolongée (B/30) (laboratoires BIOGARAN) |
34009 220 912 9 7 | DORZOLAMIDE/TIMOLOL BIOGARAN 20 mg/ml + 5 mg/ml, collyre en solution, 5 ml en flacon avec embout compte-gouttes (B/1) (laboratoires BIOGARAN) |
34009 319 346 5 3 | DROLEPTAN 20 mg/ml (dropéridol), soluté buvable en gouttes, 30 ml en flacon (laboratoires JANSSEN-CILAG) |
34009 343 756 5 1 | ECONAZOLE BIOGARAN 1 %, émulsion pour application cutanée, 30 g en flacon (laboratoires BIOGARAN) |
34009 343 754 2 2 | ECONAZOLE BIOGARAN 1 %, solution pour application cutanée, 30 g en flacon pressurisé (laboratoires BIOGARAN) |
34009 378 350 5 3 | ENALAPRIL NOR 20 mg, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 378 352 8 2 | ENALAPRIL NOR 20 mg, comprimés sécables (B/90) (laboratoires BIOGARAN) |
34009 378 347 4 2 | ENALAPRIL REF 20 mg, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 216 079 4 9 | ESOMEPRAZOLE BIOGARAN 20 mg, comprimés gastro-résistants (B/14) (laboratoires BIOGARAN) |
34009 216 081 9 9 | ESOMEPRAZOLE BIOGARAN 20 mg, comprimés gastro-résistants (B/28) (laboratoires BIOGARAN) |
34009 216 078 8 8 | ESOMEPRAZOLE BIOGARAN 20 mg, comprimés gastro-résistants (B/7) (laboratoires BIOGARAN) |
34009 216 093 7 0 | ESOMEPRAZOLE BIOGARAN 40 mg, comprimés gastro-résistants (B/14) (laboratoires BIOGARAN) |
34009 216 096 6 0 | ESOMEPRAZOLE BIOGARAN 40 mg, comprimés gastro-résistants (B/28) (laboratoires BIOGARAN) |
34009 216 275 8 9 | ESOMEPRAZOLE REF 20 mg, comprimés gastro-résistants (B/14) (laboratoires BIOGARAN) |
34009 216 277 0 1 | ESOMEPRAZOLE REF 20 mg, comprimés gastro-résistants (B/28) (laboratoires BIOGARAN) |
34009 216 274 1 1 | ESOMEPRAZOLE REF 20 mg, comprimés gastro-résistants (B/7) (laboratoires BIOGARAN) |
34009 216 287 6 0 | ESOMEPRAZOLE REF 40 mg, comprimés gastro-résistants (B/14) (laboratoires BIOGARAN) |
34009 216 289 9 9 | ESOMEPRAZOLE REF 40 mg, comprimés gastro-résistants (B/28) (laboratoires BIOGARAN) |
34009 419 199 4 7 | KETOPROFENE BIOGARAN 150 mg, comprimés sécables (B/10) (laboratoires BIOGARAN) |
34009 396 722 8 1 | KETOPROFENE BIOGARAN 150 mg, comprimés sécables (B/20) (laboratoires BIOGARAN) |
34009 278 462 6 7 | KETOPROFENE NOR LP 100 mg, comprimés sécables à libération prolongée (B/20) (laboratoires BIOGARAN) |
34009 381 039 5 3 | LANSOPRAZOLE BIOGARAN 15 mg, gélules gastro-résistantes (B/15) (laboratoires BIOGARAN) |
34009 381 040 3 5 | LANSOPRAZOLE BIOGARAN 15 mg, gélules gastro-résistantes (B/30) (laboratoires BIOGARAN) |
34009 381 032 0 5 | LANSOPRAZOLE BIOGARAN 15 mg, gélules gastro-résistantes en flacon (B/30) (laboratoires BIOGARAN) |
34009 381 063 3 6 | LANSOPRAZOLE BIOGARAN 30 mg, gélules gastro-résistantes (B/14) (laboratoires BIOGARAN) |
34009 381 443 0 7 | LANSOPRAZOLE BIOGARAN 30 mg, gélules gastro-résistantes (B/28) (laboratoires BIOGARAN) |
34009 381 061 0 7 | LANSOPRAZOLE BIOGARAN 30 mg, gélules gastro-résistantes (B/7) (laboratoires BIOGARAN) |
34009 381 051 5 5 | LANSOPRAZOLE BIOGARAN 30 mg, gélules gastro-résistantes en flacon (B/28) (laboratoires BIOGARAN) |
34009 381 054 4 5 | LANSOPRAZOLE BIOGARAN 30 mg, gélules gastro-résistantes en flacon (B/30) (laboratoires BIOGARAN) |
34009 393 374 9 4 | LEVOTHYROXINE BIOGARAN 100 microgrammes, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 393 375 5 5 | LEVOTHYROXINE BIOGARAN 100 microgrammes, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 393 376 1 6 | LEVOTHYROXINE BIOGARAN 125 microgrammes, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 393 377 8 4 | LEVOTHYROXINE BIOGARAN 125 microgrammes, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 393 378 4 5 | LEVOTHYROXINE BIOGARAN 150 microgrammes, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 393 379 0 6 | LEVOTHYROXINE BIOGARAN 150 microgrammes, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 393 380 9 5 | LEVOTHYROXINE BIOGARAN 175 microgrammes, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 393 381 5 6 | LEVOTHYROXINE BIOGARAN 175 microgrammes, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 393 382 1 7 | LEVOTHYROXINE BIOGARAN 200 microgrammes, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 393 383 8 5 | LEVOTHYROXINE BIOGARAN 200 microgrammes, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 393 338 2 3 | LEVOTHYROXINE BIOGARAN 25 microgrammes, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 393 339 9 1 | LEVOTHYROXINE BIOGARAN 25 microgrammes, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 393 343 6 3 | LEVOTHYROXINE BIOGARAN 25 microgrammes, comprimés sécables (B/90) (laboratoires BIOGARAN) |
34009 393 353 1 5 | LEVOTHYROXINE BIOGARAN 50 microgrammes, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 393 354 8 3 | LEVOTHYROXINE BIOGARAN 50 microgrammes, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 393 357 7 3 | LEVOTHYROXINE BIOGARAN 50 microgrammes, comprimés sécables (B/90) (laboratoires BIOGARAN) |
34009 393 369 5 4 | LEVOTHYROXINE BIOGARAN 75 microgrammes, comprimés sécables (B/28) (laboratoires BIOGARAN) |
34009 393 370 3 6 | LEVOTHYROXINE BIOGARAN 75 microgrammes, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 269 240 4 1 | LORAZEPAM BIOGARAN 1 mg, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 269 239 6 9 | LORAZEPAM BIOGARAN 2,5 mg, comprimés sécables (B/30) (laboratoires BIOGARAN) |
34009 398 506 0 3 | LOSARTAN REF 100 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 398 511 4 3 | LOSARTAN REF 100 mg, comprimés pelliculés (B/90) (laboratoires BIOGARAN) |
34009 398 478 7 0 | LOSARTAN REF 50 mg, comprimés pelliculés sécables (B/30) (laboratoires BIOGARAN) |
34009 398 482 4 2 | LOSARTAN REF 50 mg, comprimés pelliculés sécables (B/90) (laboratoires BIOGARAN) |
34009 352 214 7 6 | MEBEVERINE BIOGARAN 200 mg, gélules (B/30) (laboratoires BIOGARAN) |
34009 352 215 3 7 | MEBEVERINE BIOGARAN 200 mg, gélules (B/60) (laboratoires BIOGARAN) |
34009 396 622 3 7 | MELOXICAM NOR 15 mg, comprimés sécables (B/14) (laboratoires BIOGARAN) |
34009 396 595 6 5 | MELOXICAM NOR 7,5 mg, comprimés (B/14) (laboratoires BIOGARAN) |
34009 365 607 2 7 | METFORMINE BGR 1000 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 373 998 7 6 | METFORMINE BGR 1000 mg, comprimés pelliculés (B/90) (laboratoires BIOGARAN) |
34009 386 886 8 9 | METFORMINE BIOGARAN 500 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 386 887 4 0 | METFORMINE BIOGARAN 500 mg, comprimés pelliculés (B/90) (laboratoires BIOGARAN) |
34009 348 887 0 0 | METFORMINE BIOGARAN 850 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 386 898 6 0 | METFORMINE BIOGARAN 850 mg, comprimés pelliculés (B/90) (laboratoires BIOGARAN) |
34009 356 612 7 2 | METFORMINE SET 1000 mg, comprimés pelliculés sécables (B/30) (laboratoires BIOGARAN) |
34009 356 615 6 2 | METFORMINE SET 1000 mg, comprimés pelliculés sécables (B/90) (laboratoires BIOGARAN) |
34009 362 890 5 5 | PARACETAMOL CODEINE REF 500 mg/30 mg, comprimés effervescents sécables (B/16) (laboratoires BIOGARAN) |
34009 385 593 7 8 | PREDNISONE BIOGARAN 1 mg, comprimés (B/30) (laboratoires BIOGARAN) |
34009 330 894 5 0 | PREPULSID Enfant et Nourrisson 1 mg/ml (monohydrate de cisapride), suspension buvable, 100 ml en flacon avec cuillère-mesure (laboratoires JANSSEN-CILAG) |
34009 375 318 3 2 | PRODINAN 160 mg (extrait sec de serenoa repens), gélules (B/180) (laboratoires THERABEL LUCIEN PHARMA) |
34009 375 315 4 2 | PRODINAN 160 mg (extrait sec de serenoa repens), gélules (B/60) (laboratoires THERABEL LUCIEN PHARMA) |
34009 494 095 8 7 | RISEDRONATE SET 35 mg, comprimés pelliculés (B/12) (laboratoires BIOGARAN) |
34009 494 094 1 9 | RISEDRONATE SET 35 mg, comprimés pelliculés (B/4) (laboratoires BIOGARAN) |
34009 376 942 2 3 | SERTRALINE SET 25 mg, gélules (B/7) (laboratoires BIOGARAN) |
34009 370 164 8 3 | SERTRALINE SET 50 mg, gélules (B/28) (laboratoires BIOGARAN) |
34009 346 395 3 1 | TAMOXIFENE BIOGARAN 30 mg, comprimés (B/30) (laboratoires BIOGARAN) |
34009 327 412 3 6 | TINSET 2,5 mg/ml (oxatomide), suspension buvable, 90 ml en flacon verre + mesurette (laboratoires JANSSEN-CILAG) |
34009 327 411 7 5 | TINSET 30 mg (oxatomide), comprimés sécables (B/30) (laboratoires JANSSEN-CILAG) |
34009 388 101 8 9 | VENLAFAXINE BIOGARAN 50 mg, comprimés (B/30) (laboratoires BIOGARAN) |
JORF n°0125 du 1 juin 2021 Texte n° 20
Arrêté du 26 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Modification du libellé de spécialités pharmaceutiques
JORF n°0124 du 30 mai 2021 Texte n° 31
Décret n° 2021-685 du 28 mai 2021 relatif au pharmacien correspondant
JORF n°0122 du 28 mai 2021 -Texte n° 29
Arrêté du 27 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Inscription des spécialités suivantes : ALYMSYS 25mg/ml

JORF n°0121 du 27 mai 2021– Texte n° 54
Arrêté du 25 mai 2021 modifiant l’arrêté du 17 décembre 2004 fixant la liste prévue à l’article L. 5126-4 du code de la santé publique ( Inscription sur la liste de rétrocession)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 2. Antirétroviraux, les spécialités suivantes sont ajoutées :
- VOCABRIA 30 mg
- VOCABRIA 600 mg
- REKAMBYS 900 mg
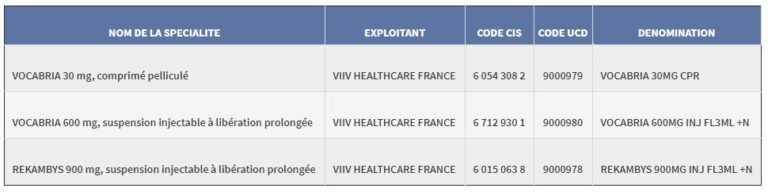
JORF n°0121 du 27 mai 2021 –Texte n° 53
Arrêté du 25 mai 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (Inscription sur la liste de rétrocession)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 1. Médicaments dérivés du sang, les spécialités suivantes sont ajoutées : CUTAQUIG 165 mg/mL
JORF n°0121 du 27 mai 2021- Texte n° 52
Arrêté du 25 mai 2021 modifiant l’arrêté du 17 décembre 2004 fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (Inscription sur la liste de rétrocession)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7. Anticancéreux, les spécialités suivantes sont ajoutées:
- BORTEZOMIB FRESENIUS KABI poudre pour solution injectable – dosage 1mg et 3,5 mg
- BORTEZOMIB TEVA , poudre pour solution injectable- dosage 3,5 mg
- PEMETREXED HOSPIRA 25 ml/ml, solution à diluer pour perfusion -25mg/ml – 20ml – 40ml – 4 ml
JORF n°0121 du 27 mai 2021 Texte n° 51
Arrêté du 25 mai 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont radiés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 3, sous-section 1, paragraphe 7 | 3143007, 3160543, 3134400 | Implants articulaires de cheville |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0121 du 27 mai 2021 Texte n° 50
Arrêté du 25 mai 2021 portant radiation de produits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale, au chapitre 1er, section 3, sous-section 1, au paragraphe 7 : « prothèses totales de cheville », dans la rubrique « Société TORNIER SAS (France) », les codes suivants sont radiés :
CODE | LIBELLÉ |
|---|---|
3143007 | Cheville, implant tibial non cimenté, TORNIER SAS (France), SALTO |
3160543 | Cheville, implant astragalien, non cimenté, TORNIER SAS (France), SALTO |
3134400 | Cheville, insert en polyéthylène, TORNIER SAS (France), SALTO |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0120 du 26 mai 2021–Texte n° 12
Arrêté du 21 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Est inscrite, sur la liste des médicaments agréés à l’usage des collectivités et divers services publics, la spécialité pharmaceutique suivante:

JORF n°0120 du 26 mai 2021–Texte n° 11
Arrêté du 21 mai 2021 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux
Est inscrite sur la liste des médicaments remboursables aux assurés sociaux la spécialité suivante:

La seule indication thérapeutique ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie est, pour la spécialité visée ci-dessus, celle qui figure à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
L’ensemble de l’information relative au VYNDAQEL dans le cadre de son AMM est consultable sur la base de données publique des médicaments (http://basedonneespublique.medicaments.gouv.fr/).
JORF n°0117 du 21 mai 2021 Texte n° 39
Arrêté du 19 mai 2021 limitant l’utilisation de médicaments de thérapie innovante à base de lymphocytes T génétiquement modifiés dits CAR-T Cells autologues à certains établissements de santé en application des dispositions de l’article L. 1151-1 du code de la santé publique
JORF n°0117 du 21 mai 2021 Texte n° 38
Arrêté du 19 mai 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La prise en charge en sus des prestations d’hospitalisation de la spécialité ci-dessous est étendue à l’indication suivante :
– dans le cadre d’une association appropriée avec d’autres médicaments dans le traitement de la tuberculose pulmonaire multirésistante (TB-MDR) chez les adolescents (âgés de 12 ans à moins de 18 ans et pesant au moins 30 kg), lorsque l’utilisation d’un autre schéma thérapeutique efficace est impossible pour des raisons de résistance ou d’intolérance.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
bedaquiline | SIRTURO 100 mg, comprimé | 3400894089612 | SIRTURO 100MG CPR | JANSSEN CILAG |
JORF n°0117 du 21 mai 2021 Texte n° 37
Arrêté du 17 mai 2021 portant homologation de la décision n° 2021-DC-0708 de l’Autorité de sûreté nucléaire du 6 avril 2021 fixant les obligations d’assurance de la qualité pour les actes utilisant des rayonnements ionisants réalisés à des fins de prise en charge thérapeutique
JORF n°0117 du 21 mai 2021 Texte n° 36
Arrêté du 17 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour les spécialités visées ci-dessous :
– traitement des femmes atteintes de la polyarthrite rhumatoïde active modérée à sévère qui ont eu une réponse inadéquate, ou une intolérance, à un ou plusieurs traitements de fond antirhumatismaux (DMARD). JYSELECA (filgotinib) peut être utilisé en monothérapie ou en association avec le méthotrexate (MTX).
Code CIP | Présentation |
|---|---|
34009 302 152 1 0 | JYSELECA 100 mg (filgotinib), comprimés pelliculés en flacon (B/30) (laboratoires GALAPAGOS SASU) |
34009 550 765 3 7 | JYSELECA 100 mg (filgotinib), comprimés pelliculés en flacon B/90 (3 x 30) (laboratoires GALAPAGOS SASU) |
34009 302 152 2 7 | JYSELECA 200 mg (filgotinib), comprimés pelliculés en flacon (B/30) (laboratoires GALAPAGOS SASU) |
34009 550 765 4 4 | JYSELECA 200 mg (filgotinib), comprimés pelliculés en flacon B/90 (3 x 30) (laboratoires GALAPAGOS SASU) |
JORF n°0117 du 21 mai 2021 Texte n° 34
Arrêté du 17 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
Rumathologie chez adulte
Polyarthrite rhumatoïde :
En association au méthotrexate, traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l’adulte en cas de réponse inadéquate aux traitements de fond, y compris le méthotrexate (sauf contre-indication).
NEPEXTO (étanercept) peut être donné en monothérapie en cas d’intolérance au méthotrexate ou lorsque la poursuite du traitement avec le méthotrexate est inadaptée.
Il a été montré que NEPEXTO (étanercept), seul ou en association avec le méthotrexate, ralentit la progression des dommages structuraux articulaires tels que mesurés par la radiographie et améliore les capacités fonctionnelles.
Rhumatisme psoriasique :
Traitement du rhumatisme psoriasique actif et évolutif de l’adulte en cas de réponse inadéquate au traitement de fond antérieur. Il a été montré que NEPEXTO (étanercept) améliore les capacités fonctionnelles chez les patients atteints de rhumatisme psoriasique, et ralentit la progression des dommages structuraux articulaires périphériques tels que mesurés par la radiographie chez les patients ayant des formes polyarticulaires symétriques de la maladie.
Spondyloarthrite axiale :
– spondylarthrite ankylosante (SA).
Traitement de la spondylarthrite ankylosante sévère et active de l’adulte en cas de réponse inadéquate au traitement conventionnel.
– spondyloarthrite axiale non radiographique.
Traitement de la spondyloarthrite axiale non radiographique sévère de l’adulte avec des signes objectifs d’inflammation, se traduisant par un taux élevé de protéine C réactive (CRP) et/ou des signes visibles à l’imagerie par résonance magnétique (IRM), en cas de réponse inadéquate aux antiinflammatoires non stéroïdiens (AINS).
Rumathologie chez l’enfant et l’adolescent
Arthrite juvénile idiopathique :
– traitement de la polyarthrite (facteur rhumatoïde positif ou négatif) et de l’oligoarthrite extensive de l’enfant à partir de 2 ans et de l’adolescent en cas de réponse inadéquate ou d’intolérance avérée au méthotrexate ;
– traitement du rhumatisme psoriasique de l’adolescent à partir de l’âge de 12 ans en cas de réponse inadéquate ou d’intolérance avérée au méthotrexate ;
– traitement de l’arthrite liée à l’enthésite de l’adolescent à partir de l’âge de 12 ans en cas de réponse inadéquate ou d’intolérance avérée au traitement de référence.
NEPEXTO (étanercept) n’a pas été étudié chez l’enfant de moins de 2 ans.
Dermatologie chez l’enfant, l’adulte
Traitement du psoriasis en plaques chronique sévère de l’enfant à partir de 6 ans, de l’adolescent et de l’adulte, défini par :
– un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie ;
– et une forme étendue et/ou un retentissement psychosocial important.
Code CIP | Présentation |
|---|---|
34009 302 122 4 0 | NEPEXTO 25 mg (étanercept), solution injectable en seringue préremplie + tampons alcoolisés (B/4) (laboratoires MYLAN MEDICAL SAS) |
34009 302 122 5 7 | NEPEXTO 50 mg (étanercept), solution injectable en seringue préremplie + tampons alcoolisés (B/4) (laboratoires MYLAN MEDICAL SAS) |
34009 302 122 6 4 | NEPEXTO 50 mg (étanercept), solution injectable en stylo prérempli + tampons alcoolisés (B/4) (laboratoires MYLAN MEDICAL SAS) |
JORF n°0117 du 21 mai 2021 Texte n° 32
Arrêté du 10 mai 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La prise en charge de la spécialité rétrocédable ci-dessous est étendue dans l’indication suivante :
– traitement de la tuberculose pulmonaire multirésistante (TB-MDR) chez les adolescents (âgés de 12 ans à moins de 18 ans et pesant au moins 30 kg), lorsque l’utilisation d’un autre schéma thérapeutique efficace est impossible pour des raisons de résistance ou d’intolérance.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 940 896 1 2 | SIRTURO 100 mg comprimé | JANSSEN-CILAG |
JORF n°0117 du 21 mai 2021 Texte n° 31
Arrêté du 10 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– traitement de la tuberculose pulmonaire multirésistante (TB-MDR) chez les adolescents (âgés de 12 ans à moins de 18 ans et pesant au moins 30 kg), lorsque l’utilisation d’un autre schéma thérapeutique efficace est impossible pour des raisons de résistance ou d’intolérance.
Code CIP | Présentation |
|---|---|
34009 300 158 1 0 | SIRTURO 100mg (bédaquiline), comprimé, plaquette thermoformée (alu/alu) (B/24) (laboratoires JANSSEN-CILAG) |
JORF n°0115 du 19 mai 2021 Texte n° 14
Arrêté du 12 mai 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 2, section 1, sous-section 1 | 3295480 | Bioprothèses valvulaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0115 du 19 mai 2021 Texte n° 13
Arrêté du 12 mai 2021 portant inscription du conduit aortique avec valve mécanique ON-X ASCENDING AORTIC PROSTHESIS de la société CRYOLIFE France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables, chapitre 2, section 1, sous-section 1 : « Bioprothèses valvulaires », paragraphe 1 « Conduits valvés comportant un tissu ou un dérivé d’origine animale », est insérée la rubrique suivante :
CODE | NOMENCLATURE |
|---|---|
Société CRYOLIFE France (CRYOLIFE) | |
3295480 | Valve cardiaque, conduit aortique valvé, CRYOLIFE, ON X AAP. Conduit aortique avec valve mécanique ON-X ASCENDING AORTIC PROSTHESIS de la société CRYOLIFE France. DESCRIPTION Le conduit aortique valvé est constitué des deux éléments suivants : ► Une prothèse valvulaire cardiaque ON-X : valve mécanique à double ailette en carbone Pyrolite. ► Une prothèse vasculaire GELWEAVE VALSALVA : prothèse tissée en polyester reproduisant la morphologie du sinus de Valsalva. Elle est imprégnée de gélatine de mammifère modifiée afin d’éviter sa pré-coagulation pendant l’intervention. INDICATIONS : Pathologies de la valve aortique et de l’aorte ascendante exposées à un risque de dissection aortique et/ou d’évolution de la valvulopathie : ► insuffisance aortique dystrophique associée à une dilatation de l’aorte ascendante, ► maladie annulo-ectasiante, ► bicuspidie aortique. Remplacement d’un conduit préalablement implanté. MODALITÉS DE PRESCRIPTION ET D’UTILISATION Les conditions techniques de fonctionnement et les conditions d’implantation applicables aux activités de chirurgie cardiaque sont précisées dans les textes suivants : ► décret n° 2006-78 du 24 janvier 2006 relatif aux conditions techniques de fonctionnement applicables aux activités de soins de chirurgie cardiaque et modifiant le code de la santé publique (dispositions réglementaires) ; ► circulaire DHOS/O4 n° 2006-293 du 3 juillet 2006 relative à l’activité de soins de chirurgie cardiaque. Par ailleurs, l’équipe médico-chirurgicale doit disposer d’un service de cardiologie permettant d’établir le diagnostic et de réaliser l’exploration hémodynamique d’urgence (cathétérisme et angiographie). RÉFÉRENCES PRISES EN CHARGE : ONXAAP-19 ; ONXAAP-21 ; ONXAAP-23 ; ONXAAP-25 ; ONXAAP-27/29 Date de fin de prise en charge : 1er juin 2026. |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0115 du 19 mai 2021 Texte n° 12
Arrêté du 10 mai 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 8. « Médicaments bénéficiant d’une autorisation temporaire d’utilisation de cohorte », les spécialités suivantes sont radiées :
| NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE UCD | DÉNOMINATION |
|---|---|---|---|
| AZD9291 40 mg, comprimé pelliculé | ASTRA ZENECA | 9407312 | AZD9291 40 MG CPR |
| AZD9291 80 mg, comprimé pelliculé | ASTRA ZENECA | 9407329 | AZD9291 80 MG CPR |
| CABOMETYX 20 mg, comprimé pelliculé | IPSEN PHARMA | 9420005 | CABOMETYX 20MG CPR |
| CABOMETYX 40 mg, comprimé pelliculé | IPSEN PHARMA | 9420011 | CABOMETYX 40MG CPR |
| CABOMETYX 60 mg, comprimé pelliculé | IPSEN PHARMA | 9420028 | CABOMETYX 60MG CPR |
| CRYSVITA 10 mg, solution injectable | KYOWA KIRIN PHARMA | 9436414 | CRYSVITA 10MG INJ FL1ML |
| CRYSVITA 30 mg, solution injectable | KYOWA KIRIN PHARMA | 9436420 | CRYSVITA 30MG INJ FL1ML |
| CYSTADROPS 0,55 %, collyre en solution | ORPHAN EUROPE | 9396235 | CYSTADROPS 0,55 % CY FL5ML |
| DUPIXENT 300mg, solution injectable | SANOFI AVENTIS FRANCE | 9428722 | DUPIXENT 300MG INJ SRG2ML |
| ELMIRON 100 mg, gélule | CEVIDRA | 9293529 | ELMIRON 100MG GELU |
| Emicizumab 30 mg/ml, solution injectable | ROCHE | 9435567 | EMICIZUMAB RCH 30MG/ML FL 1 |
| Emicizumab 150 mg/ml, solution injectable | ROCHE | 9431629 | EMICIZUMAB RCH 150MG/ML FL 1 |
| LAROTRECTINIB 25 mg, gélule | BAYER HEALTHCARE SAS | 9447375 | LAROTRECTIN.BHC 25MG GELU |
| LAROTRECTINIB 100 mg, gélule | BAYER HEALTHCARE SAS | 9447352 | LAROTRECTIN.BHC 100MG GELU |
| LAROTRECTINIB 20 mg/ml, solution buvable | BAYER HEALTHCARE SAS | 9447369 | LAROTRECTIN.BHC20MG/ML 100ML |
| LEDAGA 160 microgrammes/g gel | HELSINN BIREX PHARMACEU-TICALS | 9422990 | LEDAGA 160MCG/G GEL TB60G |
| LIKOZAM 1 mg/ml, suspension buvable | ADVICENNE | 9400391 | LIKOZAM 1 MG/ML BUV FL 150 ML + S |
| MYALEPTA 11,3 mg, poudre pour solution injectable | AMRYT PHARMACEUTICALS | 9439915 | MYALEPTA 11,3MG INJ FL2ML |
| NALSCUE 0,9mg/0,1ml, solution pour pulvérisation nasale en récipient unidose | INDIVIOR FRANCE | 9418712 | NALSCUE 0,9MG/0,1ML NAS DOS |
| NEODEX 40 mg, comprimé sécable | LABORATOIRES CTRS | 9350730 | NEODEX 40 MG CPR SECAB |
| NOYADA 5 mg/5 ml, solution buvable | MARTINDALE PHARMACEUTICALS LIMITED | 9415346 | NOYADA 5MG/5ML BUV FL 100ML |
| NOYADA 25 mg/5ml, solution buvable | MARTINDALE PHARMACEUTICALS LIMITED | 9407648 | NOYADA 25MG/5ML BUV FL 100ML |
| OCALIVA 5 mg, comprimés pelliculés | NOVEX PHARMA | 9421944 | OCALIVA 5MG CPR PELLIC |
| PROHIPPUR 750 mg/g, granulés | LUCANE PHARMA | 9423854 | PROHIPPUR 750MG/G GRLS FL250G |
| QIZENDAY 100 mg, gélule | PHARMA BLUE | 9418741 | QIZENDAY 100MG GELU |
| TALAZOPARIB 0,25 mg, gélule | PFIZER | 9442917 | TALAZOPARIB PFZ 0,25MG GELU |
| TALAZOPARIB 1 mg, gélule | PFIZER | 9438293 | TALAZOPARIB PFZ 1MG GELU |
| VENETOCLAX ABBVIE 10 mg, comprimé pelliculé | ABBVIE | 9419284 | VENETOCLAX ABV 10MG CPR |
| VENETOCLAX ABBVIE 50 mg, comprimé pelliculé | ABBVIE | 9419290 | VENETOCLAX ABV 50MG CPR |
| VENETOCLAX ABBVIE 100 mg, comprimé pelliculé | ABBVIE | 9419278 | VENETOCLAX ABV 100MG CPR |
| WAKIX 20 mg, comprimé pelliculé quadrisécable | BIOPROJET PHARMA | 9402792 | WAKIX 20 MG CPR SECAB |
JORF n°0115 du 19 mai 2021 Texte n° 10
Arrêté du 28 avril 2021 modifiant l’arrêté du 25 octobre 2018 limitant la pratique de l’acte d’implantation intraventriculaire droit d’un stimulateur cardiaque définitif simple chambre, par voie veineuse transcathéter, sans pose de sonde à certains établissements de santé en application des dispositions de l’article L. 1151-1 du code de santé publique
L’arrêté du 25 octobre 2018 susvisé est ainsi modifié :
1° L’article 2 est abrogé ;
2° L’article 3 est ainsi modifié :
« Art. 3. – La prise en charge de l’acte est conditionnée à son inscription sur la liste mentionnée à l’article L. 162-1-7 du code de la sécurité sociale dans les mêmes indications que celles du dispositif médical associé ayant obtenues un service attendu suffisant et inscrites sur la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale. » ;
3° L’article 5 est ainsi modifié :
« Art. 5. – Les critères de l’article 1er sont valides jusqu’au 1er mars 2022. »
JORF n°0114 du 18 mai 2021 Texte n° 13
Arrêté du 12 mai 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 3, sous-section 1, paragraphe 9 | 3156560 | Implants de l’articulation sacro-iliaque |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0114 du 18 mai 2021 Texte n° 12
Arrêté du 12 mai 2021 portant inscription de l’implant pour arthrodèse de l’articulation sacro-iliaque IFUSE 3D IMPLANT SYSTEM de la société SI-BONE au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables, au chapitre 1er, dans la section 3 « Implants orthopédiques », sous-section 1 « implants articulaires », au paragraphe 9 « Implants de l’articulation sacro-iliaque », dans la rubrique « Société SI-BONE (SI-BONE) », est ajouté le produit suivant :
CODE | NOMENCLATURE |
|---|---|
3156560 | Articulation sacro-iliaque, implant, SI-BONE, IFUSE 3D IMPLANT SYSTEM. Système implant pour arthrodèse de l’articulation sacro-iliaque IFUSE 3D IMPLANT SYSTEM, société SI-BONE. DESCRIPTION L’IFUSE 3D IMPLANT SYSTEM est un implant cannelé et triangulaire en titane (Ti-6Al-4V ELI) doté d’une surface poreuse (à l’intérieur et à l’extérieur) et d’orifices destinés à mimer l’os spongieux. Il est fabriqué par impression 3D conformément à la norme ASTM F3001. L’implant est proposé dans différentes tailles selon l’anatomie de l’articulation sacro-iliaque du patient (35 mm, 40 mm, 45 mm, 50 mm, 55 mm, 60 mm, 65 mm, 70 mm, 75 mm, 80 mm, 85 mm et 90 mm). INDICATIONS PRISES EN CHARGE Traitement de 2ème intention de la dysfonction de l’articulation sacro-iliaque causée par une disjonction de l’articulation sacro-iliaque ou une sacro-iliite dégénérative chez les patients non soulagés par un traitement conservateur. MODALITÉS DE PRESCRIPTION ET D’UTILISATION Avant toute implantation, le diagnostic d’une dysfonction unilatérale ou bilatérale de l’articulation sacro-iliaque doit avoir été confirmé : La positivité à trois des cinq manœuvres de provocation de la douleur (test en écartement des ailes iliaques, test en rapprochement des ailes iliaques, le test en compression verticale de chaque ASI, le test en appui sur le sacrum, le test en cisaillement des deux ASI en décubitus dorsal) ainsi que les données de l’interrogatoire, associées à la palpation de l’ASI permettent de sélectionner au mieux les patients susceptibles de bénéficier d’injections diagnostiques d’anesthésiques ou de corticoïdes dans l’articulation sacro-iliaque. Si la réaction clinique à l’injection est significativement positive, l’articulation sacro-iliaque peut être considérée comme la source de la douleur. La pose du dispositif IFUSE IMPLANT SYSTEM doit être réservée à des chirurgiens : Ayant l’habitude d’utiliser la chirurgie guidée par imagerie Et ayant suivi une formation spécifique à la pose d’IFUSE par compagnonnage. RÉFÉRENCES PRISES EN CHARGE 7035M-90 ; 7040M-90 ; 7045M-90 ; 7050M-90 ; 7055M-90 ; 7060M-90 ; 7065M-90 ; 7070M-90 ; 7075M-90 ; 7080M-90 ; 7085M-90 ; 7090M-90 Date de fin de prise en charge : 1er juin 2026. |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0114 du 18 mai 2021 Texte n° 11
Arrêté du 12 mai 2021 portant modification des conditions d’inscription de l’endoprothèse coronaire enrobée d’everolimus SYNERGY XD de la société BOSTON SCIENTIFIC inscrite au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0112 du 15 mai 2021 Texte n° 43
Arrêté du 12 mai 2021 portant changement de distributeur des dispositifs médicaux TRIANON, HIP’N GO, OSTIBONE et TENOLIG de la société FH ORTHOPEDICS inscrits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0111 du 13 mai 2021 Texte n° 52
Arrêté du 10 mai 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie et à la suppression de la participation de l’assuré sont celles qui figurent dans l’autorisation de mise sur le marché à la date de la publication du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 052 9 6 | PEMETREXED FRK 25MG/ML FL20ML | FRESENIUS KABI FRANCE |
| 34008 900 053 1 9 | PEMETREXED FRK 25MG/ML FL40ML | FRESENIUS KABI FRANCE |
| 34008 900 053 0 2 | PEMETREXED FRK 25MG/ML FL4ML | FRESENIUS KABI FRANCE |
JORF n°0111 du 13 mai 2021 Texte n° 51
Arrêté du 10 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 123 0 1 | PEMETREXED FRESENIUS KABI 25 mg/mL, solution à diluer pour perfusion, flacon (verre) de 20 ml (B/1) (laboratoires FRESENIUS KABI FRANCE) |
34009 302 123 1 8 | PEMETREXED FRESENIUS KABI 25 mg/mL, solution à diluer pour perfusion, flacon (verre) de 40 ml (B/1) (laboratoires FRESENIUS KABI FRANCE) |
34009 302 122 9 5 | PEMETREXED FRESENIUS KABI 25 mg/mL, solution à diluer pour perfusion, flacon (verre) de 4 ml (B/1) (laboratoires FRESENIUS KABI FRANCE) |
JORF n°0111 du 13 mai 2021 Texte n° 50
Arrêté du 10 mai 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La spécialité pharmaceutique rétrocédable suivantes est prise en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie et à la suppression de la participation de l’assuré sont celles qui figurent dans l’autorisation de mise sur le marché à la date de la publication du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 080 3 7 | LAMIVUDINE ARW 100MG CPR | ARROW GENERIQUES |
JORF n°0111 du 13 mai 2021 Texte n° 49
Arrêté du 10 mai 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Mésothéliome pleural malin : En association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure.
– Cancer bronchique non à petites cellules :
– en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde ;
– en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé ;
– en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
pemetrexed | PEMETREXED FRESENIUS KABI 25 mg/ml, solution à diluer pour perfusion | 3400890005296 | PEMETREXED FRK 25MG/ML FL20ML | FRESENIUS KABI FRANCE |
pemetrexed | PEMETREXED FRESENIUS KABI 25 mg/ml, solution à diluer pour perfusion | 3400890005319 | PEMETREXED FRK 25MG/ML FL40ML | FRESENIUS KABI FRANCE |
pemetrexed | PEMETREXED FRESENIUS KABI 25 mg/ml, solution à diluer pour perfusion | 3400890005302 | PEMETREXED FRK 25MG/ML FL4ML | FRESENIUS KABI FRANCE |
JORF n°0110 du 12 mai 2021 Texte n° 32
Arrêté du 6 mai 2021 relatif à la prise en charge précoce d’une spécialité pharmaceutique en application du II de l’article L. 162-16-5-2 du code de la sécurité sociale et du II de l’article R. 163-32-1 du même code
En application du II de l’article L. 162-16-5-2 du code de la sécurité sociale et du II de l’article R. 163-32-1 du même code, les spécialités pharmaceutiques mentionnées en annexe du présent arrêté sont prises en charge par l’assurance maladie, dans les indications mentionnées dans ladite annexe.
Les spécialités pharmaceutiques qui figurent en annexe, pour les indications mentionnées dans ladite annexe, sont fournies, achetées, utilisées et prises en charge par les établissements de santé conformément à l’article L. 5123-2 du code de la santé publique.
Elles sont vendues au public et au détail par les seules pharmacies à usage intérieur autorisées, conformément aux dispositions mentionnées aux articles L. 5126-6 et R. 5126-60 du code de la santé publique. Elles donnent lieu à remboursement ou prise en charge dans ce cadre sans participation de l’assuré en application des dispositions de l’article R. 160-8 susvisé.
Les spécialités pharmaceutiques qui figurent en annexe sont soumises à prescription hospitalière. Cette prescription est réservée à certains médecins spécialistes (PRS) en pédiatrie, en endocrinologie, diabète et nutrition, en néphrologie ou en rhumatologie.
Conformément à l’arrêté du 11 octobre 2019 susmentionné et en application du III de l’article R. 163-32-1 du code de la sécurité sociale, le prescripteur indique sur l’ordonnance la mention : « La prise en charge de cette spécialité intervient dans le cadre d’une prise en charge “précoce” par l’assurance maladie. A ce titre, cette prise en charge ne peut être que transitoire. »
ANNEXE
(3 spécialités)
Les spécialités suivates sont prises en charge au titre du II de l’article L. 162-16-5-2 du code de la sécurité sociale et du II de l’article R. 163-32-1 du même code dans les indications thérapeutique suivantes :
Dans le traitement de l’hypophosphatémie liée à l’X chez les adolescents présentant des signes radiographiques d’atteinte osseuse et chez les adultes :
– les patients actuellement traités par burosumab (dans le cadre de l’indication pédiatrique) et pour lesquels une interruption de traitement n’est pas envisageable car présentant une maladie active malgré traitement conventionnel, une contre-indication ou une intolérance au traitement conventionnel :
– patients devenant « adulte » administrativement parlant avant le remboursement officiel de l’indication adulte ;
– patients adolescents (< 18 ans) terminant leur croissance car ces patients n’étaient pas compris dans l’AMM initiale qui précisait « en phase de croissance » ;
L’objectif est d’assurer une continuité de traitement chez ces patients en transition de l’indication initiale pédiatrique à l’indication actuelle.
– les patients adultes symptomatiques (douleurs, raideurs, fatigue…) et présentant une maladie active avec atteinte structurale (pseudo-fractures, fractures, arthrose précoce, enthésiopathies…) avec altération majeure de leur qualité de vie (sujet jeune avec aide technique, arrêt d’activité professionnelle, prise de poids…) voire nécessitant une intervention chirurgicale orthopédique (afin d’assurer d’une bonne consolidation osseuse) malgré un traitement conventionnel ou en cas de contre-indication ou d’intolérance au traitement conventionnel.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
burosumab | CRYSVITA 10 mg, solution injectable | 3400894364146 | CRYSVITA 10MG INJ FL1ML | KYOWA KIRIN PHARMA |
burosumab | CRYSVITA 20 mg, solution injectable | 3400894381815 | CRYSVITA 20MG INJ FL1ML | KYOWA KIRIN PHARMA |
burosumab | CRYSVITA 30 mg, solution injectable | 3400894364207 | CRYSVITA 30MG INJ FL1ML | KYOWA KIRIN PHARMA |
JORF n°0110 du 12 mai 2021 Texte n° 31
Arrêté du 5 mai 2021 modifiant l’arrêté du 17 décembre 2004 fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 5. Antifongiques, la spécialité suivante est ajoutée, pour une durée déterminée de 1 an à partir de la date de publication du présent arrêté :
| NOM DE LA SPECIALITE | EXPLOITANT | CODE CIS | CODE UCD | DENOMINATION |
|---|---|---|---|---|
| POTELIGEO 4 mg/mL, solution à diluer pour perfusion | KYOWA KIRIN PHARMA | 6 229 277 1 | 9442834 | POTELIGEO 4MG/ML PERF FL5ML |
JORF n°0110 du 12 mai 2021 Texte n° 30
Arrêté du 5 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 301 927 3 3 | BUVIDAL 128 mg (buprénorphine), solution injectable à libération prolongée, seringue préremplie (verre) de 0,36 ml (B/1) (laboratoires MEDIPHA SANTE) |
34009 301 926 8 9 | BUVIDAL 16 mg (buprénorphine), solution injectable à libération prolongée, seringue préremplie (verre) de 0,32 ml (B/1) (laboratoires MEDIPHA SANTE) |
34009 301 926 9 6 | BUVIDAL 24 mg (buprénorphine), solution injectable à libération prolongée, seringue préremplie (verre) de 0,48 ml (B/1) (laboratoires MEDIPHA SANTE) |
34009 301 927 0 2 | BUVIDAL 32 mg (buprénorphine), solution injectable à libération prolongée, seringue préremplie (verre) de 0,64 ml (B/1) (laboratoires MEDIPHA SANTE) |
34009 301 927 1 9 | BUVIDAL 64 mg (buprénorphine), solution injectable à libération prolongée, seringue préremplie (verre) de 0,18 ml (B/1) (laboratoires MEDIPHA SANTE) |
34009 301 926 7 2 | BUVIDAL 8 mg (buprénorphine), solution injectable à libération prolongée, seringue préremplie (verre) de 0,16 ml (B/1) (laboratoires MEDIPHA SANTE) |
34009 301 927 2 6 | BUVIDAL 96 mg (buprénorphine), solution injectable à libération prolongée, seringue préremplie (verre) de 0,27 ml (B/1) (laboratoires MEDIPHA SANTE) |
34009 302 102 4 6 | OXYGENE MEDICINAL AIR LIQUIDE SANTE FRANCE 200 bar, gaz pour inhalation, en bouteille, bouteille de 11 L en aluminium ou en aluminium frettée (corps et ogive peints selon une couleur normalisée), munie d’un robinet en laiton avec manodétendeur intégré à simple détente, et prises normalisées (bouteilles Oyan) (laboratoires AIR LIQUIDE SANTE FRANCE) |
34009 302 102 5 3 | OXYGENE MEDICINAL AIR LIQUIDE SANTE FRANCE 200 bar, gaz pour inhalation, en bouteille, bouteille de 15 L en aluminium ou en aluminium frettée (corps et ogive peints selon une couleur normalisée), munie d’un robinet en laiton avec manodétendeur intégré à simple détente, et prises normalisées (bouteille Oyan) (laboratoires AIR LIQUIDE SANTE FRANCE) |
34009 302 102 2 2 | OXYGENE MEDICINAL AIR LIQUIDE SANTE FRANCE 200 bar, gaz pour inhalation, en bouteille, bouteille de 2 L en aluminium (corps et ogive peints selon une couleur normalisée), munie d’un robinet en laiton avec manodétendeur intégré à simple détente, et prises normalisées (bouteille Oyan) (laboratoires AIR LIQUIDE SANTE FRANCE) |
34009 302 102 3 9 | OXYGENE MEDICINAL AIR LIQUIDE SANTE FRANCE 200 bar, gaz pour inhalation, en bouteille, bouteille de 5 L en aluminium ou en aluminium frettée (corps et ogive peints selon une couleur normalisée), munie d’un robinet en laiton avec manodétendeur intégré à simple détente, et prises normalisées (bouteille Oyan) (laboratoires AIR LIQUIDE SANTE FRANCE) |
34009 302 178 3 2 | SELENIUM PANPHARMA 100 microgrammes, solution injectable, ampoules (verre) de 2 ml (B/10) (laboratoires PANPHARMA) |
34009 301 060 9 9 | SMOFKABIVEN E PROTEINE, émulsion pour perfusion, 1 518 ml en poche à 3 compartiments (BIOFINE)(B/4) (laboratoires FRESENIUS KABI FRANCE) |
Les indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie, pour les spécialités visées ci-dessous, concernent uniquement les hommes adultes ayant des troubles de l’érection liés à l’une des pathologies suivantes :
– neuropathie diabétique ;
– para ou tétraplégie ;
– séquelles d’acte chirurgical (prostatectomie, cystectomie totale et exérèse colorectale) ou de la radiothérapie abdomino-pelvienne ;
– sclérose en plaques ;
– séquelles de priapisme ;
– séquelles de la chirurgie vasculaire (anévrisme de l’aorte) ;
– traumatismes du bassin compliqués de troubles urinaires ;
– hommes ayant un trouble de l’érection dû à un traitement au long cours par un antipsychotique.
Code CIP | Présentation |
|---|---|
34009 218 318 6 3 | SILDENAFIL EG 100 mg, comprimé pelliculé, comprimés sous plaquettes thermoformées (PVC/PVDC-Aluminium) (B/12) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 279 050 3 2 | SILDENAFIL EG 100 mg, comprimé pelliculé, comprimés sous plaquettes thermoformées (PVC/PVDC-Aluminium) (B/24) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 218 315 7 3 | SILDENAFIL EG 100 mg, comprimé pelliculé, comprimés sous plaquettes thermoformées (PVC/PVDC-Aluminium) (B/4) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 218 316 3 4 | SILDENAFIL EG 100 mg, comprimé pelliculé, comprimés sous plaquettes thermoformées (PVC/PVDC-Aluminium) (B/8) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 218 311 1 5 | SILDENAFIL EG 50 mg, comprimé pelliculé, comprimés sous plaquettes thermoformées (PVC/PVDC-Aluminium) (B/12) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 218 309 7 2 | SILDENAFIL EG 50 mg, comprimé pelliculé, comprimés sous plaquettes thermoformées (PVC/PVDC-Aluminium) (B/4) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 218 310 5 4 | SILDENAFIL EG 50 mg, comprimé pelliculé, comprimés sous plaquettes thermoformées (PVC/PVDC-Aluminium) (B/8) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
(2 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit.
Ancien libellé | Nouveau libellé | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 582 403 6 2 | DIFICLIR 200 mg, comprimé pelliculé, plaquette thermoformée (alu/alu) – Boîte de 10 x 10 comprimés (B/100) (Laboratoires ASTELLAS PHARMA SAS) | 34009 582 403 6 2 | DIFICLIR 200 mg, comprimé pelliculé, plaquette thermoformée (alu/alu) – Boîte de 10 x 10 comprimés (B/100) (Laboratoires TILLOTTS PHARMA FRANCE S.A.S.) |
34009 222 376 7 1 | DIFICLIR 200 mg, comprimé pelliculé, plaquette thermoformée (alu/alu) – Boîte de 2 x 10 comprimés (B/20) (Laboratoires ASTELLAS PHARMA SAS) | 34009 222 376 7 1 | DIFICLIR 200 mg, comprimé pelliculé, plaquette thermoformée (alu/alu) – Boîte de 2 x 10 comprimés (B/20) (Laboratoires TILLOTTS PHARMA FRANCE S.A.S.) |
JORF n°0110 du 12 mai 2021 Texte n° 27
Arrêté du 30 avril 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 6. « Autres médicaments », la spécialité suivante est radiée :
| NOM DE LA SPÉCIALITÉ | EXPLOITANT OU TITULAIRE | CODE UCD | DÉNOMINATION |
|---|---|---|---|
| SALVACYL LP 11,25 mg, poudre et solvant pour suspension injectable à libération prolongée. | IPSEN | 9324299 | SALVACYL LP 11,25 MG INJ FL + A. |
JORF n°0110 du 12 mai 2021 Texte n° 26
Arrêté du 30 avril 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 7. « Anticancéreux », les spécialités suivantes sont ajoutées :
| NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
| Lenalidomide Accord 2,5 mg gélule | ACCORD HEALTHCARE FRANCE | 6 136 528 0 | 9001125 | LENALIDOMIDE ACC 2,5MG GELU |
| Lenalidomide Accord 5 mg gélule | ACCORD HEALTHCARE FRANCE | 6 400 237 3 | 9001128 | LENALIDOMIDE ACC 5MG GELU |
| Lenalidomide Accord 7,5 mg gélule | ACCORD HEALTHCARE FRANCE | 6 861 521 7 | 9001129 | LENALIDOMIDE ACC 7,5MG GELU |
| Lenalidomide Accord 10 mg gélule | ACCORD HEALTHCARE FRANCE | 6 584 291 8 | 9001123 | LENALIDOMIDE ACC 10MG GELU |
| Lenalidomide Accord 15 mg gélule | ACCORD HEALTHCARE FRANCE | 6 419 488 8 | 9001124 | LENALIDOMIDE ACC 15MG GELU |
| Lenalidomide Accord 20 mg gélule | ACCORD HEALTHCARE FRANCE | 6 527 515 4 | 9001126 | LENALIDOMIDE ACC 20MG GELU |
| Lenalidomide Accord 25 mg gélule | ACCORD HEALTHCARE FRANCE | 6 063 211 1 | 9001127 | LENALIDOMIDE ACC 25MG GELU |
| LENALIDOMIDE OHRE PHARMA 2,5 mg, gélule | OHRE PHARMA | 6 160 206 0 | 9001232 | LENALIDOMIDE OHR 2,5MG GELU |
| LENALIDOMIDE OHRE PHARMA 5 mg, gélule | OHRE PHARMA | 6 289 396 4 | 9001235 | LENALIDOMIDE OHR 5MG GELU |
| LENALIDOMIDE OHRE PHARMA 7,5 mg, gélule | OHRE PHARMA | 6 776 471 7 | 9001236 | LENALIDOMIDE OHR 7,5MG GELU |
| LENALIDOMIDE OHRE PHARMA 10 mg, gélule | OHRE PHARMA | 6 620 589 9 | 9001229 | LENALIDOMIDE OHR 10MG GELU |
| LENALIDOMIDE OHRE PHARMA 15 mg, gélule | OHRE PHARMA | 6 424 969 0 | 9001230 | LENALIDOMIDE OHR 15MG GELU |
| LENALIDOMIDE OHRE PHARMA 20 mg, gélule | OHRE PHARMA | 6 007 686 0 | 9001233 | LENALIDOMIDE OHR 20MG GELU |
| LENALIDOMIDE OHRE PHARMA 25 mg, gélule | OHRE PHARMA | 6 489 952 8 | 9001234 | LENALIDOMIDE OHR 25MG GELU |
JORF n°0107 du 7 mai 2021 Texte n° 30
Arrêté du 3 mai 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une recommandation temporaire d’utilisation et pris en application de l’article L. 162-17-2-1 du code de la sécurité sociale
En application de l’article L. 162-17-2-1 du code de la sécurité sociale et dans le cadre de la recommandation temporaire d’utilisation dont elles font l’objet, la spécialité pharmaceutique mentionnée en annexe du présent arrêté est prise en charge, pour une durée de trois ans, dans l’indication mentionnée dans ladite annexe.
La spécialité pharmaceutique dans l’indication mentionnée en annexe du présent arrêté est réservé à l’usage hospitalier et sa prescription est réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie ou en maladies du sang.
L’entreprise exploitant la spécialité pharmaceutique figurant en annexe est tenue de mettre en place le suivi des patients selon les modalités prévues dans le protocole mentionné à l’article R. 5121-76-1 du code de la santé publique.
ANNEXE
Libellé de la spécialité pharmaceutique prise en charge et laboratoire exploitant | Indication objet de la recommandation temporaire d’utilisation |
|---|---|
IMFINZI 50 mg/mL, solution à diluer pour perfusion (Durvalumab) Laboratoire ASTRAZENECA | Traitement des patients adultes atteints d’un cancer bronchique non à petites cellules (CBNPC) localement avance non opérable et dont la maladie n’a pas progressé après une chimioradiothérapie à base de platine, en cas d’expression tumorale de pd-l1 < 1% ou dans le cas où ce statut est recherché mais le résultat de ce marqueur n’est pas exploitable (statut inconnu). |
JORF n°0107 du 7 mai 2021 Texte n° 31
Arrêté du 5 mai 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les libellés des indications thérapeutiques des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnées à l’article L. 162-22-7 du code de la sécurité sociale suivantes sont modifiés comme suit :
Anciens libellés | |||
|---|---|---|---|
Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Ancien libellé de l’indication thérapeutique prise en charge |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894073703 | HYQVIA 100MG/ML PERF F+F100ML | Traitement substitutif chez l’adulte, l’enfant et l’adolescent (âgé de 0 à 18 ans) atteints de : – déficits immunitaires primitifs (DIP) avec production défaillante d’anticorps (voir rubrique 4.4) ; – hypogammaglobulinémie et infections bactériennes récurrentes chez des patients atteints de leucémie lymphoïde chronique (LLC), chez qui les antibiotiques prophylactiques n’ont pas fonctionné ou sont contre-indiqués ; – hypogammaglobulinémie et infections bactériennes récurrentes chez des patients atteints de myélome multiple ; – hypogammaglobulinémie chez des patients avant ou après une transplantation de cellules souches hématopoïétiques allogènes. |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894073871 | HYQVIA 100MG/ML PERF F+F200ML | |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894073932 | HYQVIA 100MG/ML PERF F+F25ML | |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894074014 | HYQVIA 100MG/ML PERF F+F300ML | |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894074182 | HYQVIA 100MG/ML PERF F+F50ML | |
Nouveaux libellés | |||
|---|---|---|---|
Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Nouveau libellé de l’indication thérapeutique prise en charge |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894073703 | HYQVIA 100MG/ML PERF F+F100ML | Traitement substitutif chez l’adulte, l’enfant et l’adolescent (âgé de 0 à 18 ans) atteints de : – déficits immunitaires primitifs (DIP) avec altération de la production d’anticorps : – déficits immunitaires secondaires (DIS) chez les patients souffrant d’infections sévères ou récurrentes, sous traitement antimicrobien inefficace, et présentant soit un déficit avéré des anticorps spécifiques (DAAS)*, soit d’un taux d’IgG sérique de < 4 g/l. * DAAS : défaut de réponse vaccinale définie par un échec du doublement du titre des anticorps IgG après un vaccin pneumococcique utilisant des antigènes polypeptidiques et polysaccharidiques. |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894073871 | HYQVIA 100MG/ML PERF F+F200ML | |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894073932 | HYQVIA 100MG/ML PERF F+F25ML | |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894074014 | HYQVIA 100MG/ML PERF F+F300ML | |
HYQVIA 100 mg/ml, solution pour perfusion par voie sous-cutanée | 3400894074182 | HYQVIA 100MG/ML PERF F+F50ML | |
JORF n°0106 du 6 mai 2021 Texte n° 24
Arrêté du 30 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(20 inscriptions)
1. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 077 5 8 | ATECTURA BREEZHALER 125 microgrammes/127,5 microgrammes (indacatérol, mométasone), poudre pour inhalation, gélules en plaquette unitaire prédécoupée (B/10) + 1 inhalateur (laboratoires NOVARTIS PHARMA SAS) |
34009 302 077 7 2 | ATECTURA BREEZHALER 125 microgrammes/127,5 microgrammes (indacatérol, mométasone), poudre pour inhalation, gélules en plaquette unitaire prédécoupée (B/30) + 1 inhalateur (laboratoires NOVARTIS PHARMA SAS) |
34009 302 077 8 9 | ATECTURA BREEZHALER 125 microgrammes/260 microgrammes (indacatérol, mométasone), poudre pour inhalation, gélules en plaquette unitaire prédécoupée (B/10) + 1 inhalateur (laboratoires NOVARTIS PHARMA SAS) |
34009 302 077 9 6 | ATECTURA BREEZHALER 125 microgrammes/260 microgrammes (indacatérol, mométasone), poudre pour inhalation, gélules en plaquette unitaire prédécoupée (B/30) + 1 inhalateur (laboratoires NOVARTIS PHARMA SAS) |
34009 302 077 3 4 | ATECTURA BREEZHALER 125 microgrammes/62,5 microgrammes (indacatérol, mométasone), poudre pour inhalation, gélules en plaquette unitaire prédécoupée (B/10) + 1 inhalateur (laboratoires NOVARTIS PHARMA SAS) |
34009 302 077 4 1 | ATECTURA BREEZHALER 125 microgrammes/62,5 microgrammes (indacatérol, mométasone), poudre pour inhalation, gélules en plaquette unitaire prédécoupée (B/30) + 1 inhalateur (laboratoires NOVARTIS PHARMA SAS) |
34009 490 043 6 2 | ATORVASTATINE MYLAN 10 mg, comprimés pelliculés sous plaquettes opaques polyamide aluminium PVC-Aluminium (B/30) (laboratoires BB FARMA) |
34009 490 043 5 5 | ATORVASTATINE MYLAN 10 mg, comprimés pelliculés sous plaquettes opaques polyamide aluminium PVC-Aluminium (B/90) (laboratoires BB FARMA) |
34009 301 991 4 5 | DOTAREM 0,5 mmol/ml (acide gadotérique), solution injectable, 10 ml en seringue pré-remplie en plastique (B/1) (laboratoires GUERBET) |
34009 490 042 6 3 | GABAPENTINE MYLAN 300 mg, gélules en plaquette PVC-Aluminium (B/90) (laboratoires BB FARMA) |
34009 302 212 2 8 | GIBITER EASYHALER 160 microgrammes/4,5 microgrammes/dose (budésonide, formotérol), poudre pour inhalation, en inhalateur-doseur Easyhaler de 120 doses (B/3) (laboratoires MENARINI FRANCE) |
34009 302 211 9 8 | GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose (budésonide, formotérol), poudre pour inhalation, en inhalateur-doseur Easyhaler de 60 doses (B/3) (laboratoires MENARINI FRANCE) |
34009 490 043 7 9 | PURINETHOL 50 mg (mercaptopurine), comprimés sécables en flacon (B/25) (laboratoires BB FARMA) |
34009 302 094 0 0 | SYMBICORT RAPIHALER 100/3 microgrammes par dose (budésonide, formotérol), suspension pour inhalation, 120 doses en flacon pressurisé (laboratoires ASTRAZENECA) |
34009 490 043 1 7 | TEMERITDUO 5 mg/12,5 mg (nébivolol, hydrochlorothiazide), comprimés pelliculés (B/30) (laboratoires BB FARMA) |
34009 490 043 2 4 | TEMERITDUO 5 mg/12,5 mg (nébivolol, hydrochlorothiazide), comprimés pelliculés (B/90) (laboratoires BB FARMA) |
34009 490 042 9 4 | TEMERITDUO 5 mg/25 mg (nébivolol, hydrochlorothiazide), comprimés pelliculés (B/30) (laboratoires BB FARMA) |
34009 490 043 0 0 | TEMERITDUO 5 mg/25 mg (nébivolol, hydrochlorothiazide), comprimés pelliculés (B/90) (laboratoires BB FARMA) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
TRULICITY est indiqué chez l’adulte atteint de diabète de type 2 pour améliorer le contrôle de la glycémie, en association avec d’autres hypoglycémiants, y compris l’insuline, lorsque ces derniers, associés à un régime alimentaire et à une activité physique, ne permettent pas d’obtenir un contrôle adéquat de la glycémie, uniquement :
– en bithérapie avec la metformine ;
– en trithérapie avec metformine et insuline ou avec metformine et sulfamide hypoglycémiant.
Code CIP | Présentation |
|---|---|
34009 302 164 5 3 | TRULICITY 3 mg (dulaglutide), solution injectable en stylo pré-rempli (B/4) (laboratoires LILLY FRANCE SAS) |
34009 302 164 8 4 | TRULICITY 4,5 mg (dulaglutide), solution injectable en stylo pré-rempli (B/4) (laboratoires LILLY FRANCE SAS) |
DEUXIÈME PARTIE
(Extension d’indication)
La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– prophylaxie des troubles thromboemboliques notamment chez les patients atteints d’une affection médicale aiguë (telle que : insuffisance cardiaque aiguë, insuffisance respiratoire, infections sévères ou maladies rhumatismales) et dont la mobilité est réduite, à risque thromboembolique veineux augmenté.
Code CIP | Présentation |
|---|---|
34009 327 827 9 6 | FRAXIPARINE 2 850 UI AXa/0,3 ml, (nadroparine calcique), solution injectable (SC), 0,3 ml en seringue pré-remplie avec système de sécurité : manchon plastique transparent (B/10) (laboratoires ASPEN FRANCE) |
34009 327 825 6 7 | FRAXIPARINE 2 850 UI AXa/0,3 ml, (nadroparine calcique), solution injectable (SC), 0,3 ml en seringue pré-remplie avec système de sécurité : manchon plastique transparent (B/2) (laboratoires ASPEN FRANCE) |
34009 333 891 7 8 | FRAXIPARINE 2 850 UI AXa/0,3 ml, (nadroparine calcique), solution injectable (SC), 0,3 ml en seringue pré-remplie avec système de sécurité : manchon plastique transparent (B/6) (laboratoires ASPEN FRANCE) |
34009 300 735 1 3 | FRAXIPARINE 3 800 UI AXa/0,4 ml (nadroparine calcique), solution injectable (SC), 0,4 ml en seringue pré-remplie avec système de sécurité : manchon plastique transparent (B/10) (laboratoires ASPEN FRANCE) |
34009 327 831 6 8 | FRAXIPARINE 5 700 UI AXa/0,6 ml (nadroparine calcique), solution injectable (SC), 0,6 ml en seringue préremplie avec système de sécurité : manchon plastique transparent (B/10) (laboratoires ASPEN FRANCE) |
34009 327 828 5 7 | FRAXIPARINE 5 700 UI AXa/0,6 ml (nadroparine calcique), solution injectable (SC), 0,6 ml en seringue pré-remplie avec système de sécurité : manchon plastique transparent (B/2) (laboratoires ASPEN FRANCE) |
34009 334 876 1 4 | FRAXIPARINE 5 700 UI AXa/0,6 ml (nadroparine calcique), solution injectable (SC), 0,6 ml en seringue pré-remplie avec système de sécurité : manchon plastique transparent (B/6) (laboratoires ASPEN FRANCE) |
TROISIÈME PARTIE
(3 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit :
Libellés abrogés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 301 117 9 6 | MAVENCLAD 10 mg (cladribine), comprimés (B/1) (Laboratoires MERCK SANTE S.A.S.) | 34009 301 117 9 6 | MAVENCLAD 10 mg (cladribine), comprimés (B/1) (Laboratoires MERCK SERONO) |
34009 301 118 1 9 | MAVENCLAD 10 mg (cladribine), comprimés (B/4) (Laboratoires MERCK SANTE S.A.S.) | 34009 301 118 1 9 | MAVENCLAD 10 mg (cladribine), comprimés (B/4) (Laboratoires MERCK SERONO) |
34009 301 118 3 3 | MAVENCLAD 10 mg (cladribine), comprimés (B/6) (Laboratoires MERCK SANTE S.A.S.) | 34009 301 118 3 3 | MAVENCLAD 10 mg (cladribine), comprimés (B/6) (Laboratoires MERCK SERONO) |
JORF n°0103 du 2 mai 2021 Texte n° 60
Arrêté du 19 avril 2021 relatif à l’expérimentation pour l’incitation à la prescription hospitalière de médicaments biologiques délivrés en ville
JORF n°0103 du 2 mai 2021 Texte n° 59
Arrêté du 19 avril 2021 relatif à l’efficience et la pertinence de la prescription hospitalière de médicaments biologiques délivrés en ville
JORF n°0102 du 30 avril 2021 Texte n° 80
Arrêté du 27 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– en monothérapie ou en association avec la dexaméthasone, pour le traitement des patients adultes atteints de myélome multiple en progression, ayant reçu au moins 1 traitement antérieur et ayant déjà bénéficié ou étant inéligibles à une greffe de cellules souches hématopoïétiques ;
– en association avec le melphalan et la prednisone, pour le traitement des patients adultes atteints de myélome multiple non traité au préalable, non éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec la dexaméthasone, ou avec la dexaméthasone et au thalidomide, pour le traitement d’induction des patients adultes atteints de myélome multiple non traité au préalable, éligibles à la chimiothérapie intensive accompagnée d’une greffe de cellules souches hématopoïétiques ;
– en association avec le rituximab, le cyclophosphamide, la doxorubicine et la prednisone, pour le traitement des patients adultes atteints d’un lymphome à cellules du manteau non traité au préalable et qui ne sont pas éligibles à une greffe de cellules souches hématopoïétiques.
Code CIP | Présentation |
|---|---|
34009 550 772 8 2 | BORTEZOMIB ARROW 3,5 mg, poudre pour solution injectable, poudre en flacon (verre) (B/1) (laboratoires ARROW GENERIQUES) |
JORF n°0102 du 30 avril 2021 Texte n° 79
Arrêté du 27 avril 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La prise en charge des spécialités rétrocédables ci-dessous est étendue dans les indications suivantes :
– traitement de première intention, en association aux glucocorticoïdes, pour l’induction de la rémission chez les patients pédiatriques (âgés de ≥ 2 à < 18 ans) atteints de GPA (maladie de Wegener) et de PAM, sévères et actives ;
– en association aux glucocorticoïdes, pour le traitement des patients adultes atteints de granulomatose avec polyangéite (GPA) (maladie de Wegener) et de polyangéite microscopique (PAM) sévères et actives ;
– traitement de première intention en association à la chimiothérapie dans le traitement des patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) non précédemment traités présentant à un stade avancé : un lymphome diffus à grandes cellules B (LDGCB) CD20 positif, un lymphome de Burkitt (LB)/une leucémie de Burkitt (leucémie aiguë à cellules B matures) (LA-B) ou un lymphome Burkitt-like (LB-like).
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 942 816 5 8 | TRUXIMA 100MG PERF FL10ML | BIOGARAN |
34008 942 383 1 7 | TRUXIMA 500MG PERF FL50ML | BIOGARAN |
La prise en charge des spécialités rétrocédables ci-dessous est étendue dans les indications suivantes :
– traitement de première intention, en association aux glucocorticoïdes, pour l’induction de la rémission chez les patients pédiatriques (âgés de ≥ 2 à < 18 ans) atteints de GPA (maladie de Wegener) et de PAM, sévères et actives ;
– traitement de première intention en association à la chimiothérapie dans le traitement des patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) non précédemment traités présentant à un stade avancé : un lymphome diffus à grandes cellules B (LDGCB) CD20 positif, un lymphome de Burkitt (LB)/une leucémie de Burkitt (leucémie aiguë à cellules B matures) (LA-B) ou un lymphome Burkitt-like (LB-like).
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 942 745 0 6 | RIXATHON 100MG PERF FL10ML | SANDOZ |
34008 942 746 7 4 | RIXATHON 500MG PERF FL50ML | SANDOZ |
JORF n°0102 du 30 avril 2021 Texte n° 78
Arrêté du 27 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue dans les indications suivantes :
– traitement de première intention, en association aux glucocorticoïdes, pour l’induction de la rémission chez les patients pédiatriques (âgés de ≥ 2 à < 18 ans) atteints de GPA (maladie de Wegener) et de PAM, sévères et actives ;
– traitement de première intention en association à la chimiothérapie dans le traitement des patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) non précédemment traités présentant à un stade avancé : un lymphome diffus à grandes cellules B (LDGCB) CD20 positif, un lymphome de Burkitt (LB)/une leucémie de Burkitt (leucémie aiguë à cellules B matures) (LA-B) ou un lymphome Burkitt-like (LB-like) ;
– en association aux glucocorticoïdes, pour le traitement des patients adultes atteints de granulomatose avec polyangéite (GPA) (maladie de Wegener) et de polyangéite microscopique (PAM) sévères et actives ;
– traitement des patients atteints de pemphigus vulgaris (PV) modéré à sévère.
Code CIP | Présentation |
|---|---|
34009 301 053 7 5 | TRUXIMA (rituximab) 100 mg, solution à diluer pour perfusion, flacon (verre) de 10 ml (10 mg/ml) (B/2) (laboratoires BIOGARAN) |
34009 300 830 3 1 | TRUXIMA (rituximab) 500 mg, solution à diluer pour perfusion, flacon (verre) de 50 ml (10 mg/ml) (B/1) (laboratoires BIOGARAN) |
La prise en charge des spécialités ci-dessous est étendue dans les indications suivantes :
– traitement de première intention, en association aux glucocorticoïdes, pour l’induction de la rémission chez les patients pédiatriques (âgés de ≥ 2 à < 18 ans) atteints de GPA (maladie de Wegener) et de PAM, sévères et actives ;
– traitement de première intention en association à la chimiothérapie dans le traitement des patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) non précédemment traités présentant à un stade avancé : un lymphome diffus à grandes cellules B (LDGCB) CD20 positif, un lymphome de Burkitt (LB)/une leucémie de Burkitt (leucémie aiguë à cellules B matures) (LA-B) ou un lymphome Burkitt-like (LB-like).
Code CIP | Présentation |
|---|---|
34009 550 344 5 2 | RIXATHON 100 mg (rituximab), solution à diluer pour perfusion, flacon (verre) – boîte de 2 flacons (B/2) (laboratoires SANDOZ) |
34009 550 344 6 9 | RIXATHON 500 mg (rituximab), solution à diluer pour perfusion, flacon (verre) – boîte de 1 flacon (B/1) (laboratoires SANDOZ) |
JORF n°0102 du 30 avril 2021 Texte n° 67
Arrêté du 26 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement des patients atteints de fièvre méditerranéenne familiale (FMF) ayant une résistance, une intolérance ou une contre-indication à la colchicine.
Code CIP | Présentation |
|---|---|
34009 277 319 5 2 | KINERET 100 mg/0,67 ml (anakinra), solution injectable en seringue préremplie (B/1) (laboratoires SWEDISH ORPHAN BIOVITRUM) |
34009 277 322 6 3 | KINERET 100 mg/0,67 ml (anakinra), solution injectable en seringue préremplie (B/28) (laboratoires SWEDISH ORPHAN BIOVITRUM) |
34009 277 320 3 4 | KINERET 100 mg/0,67 ml (anakinra), solution injectable en seringue préremplie (B/7) (laboratoires SWEDISH ORPHAN BIOVITRUM) |
JORF n°0102 du 30 avril 2021 Texte n° 65
Arrêté du 26 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(17 inscriptions)
1. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
– traitement du carcinome hépatocellulaire chez les patients de bon pronostic ayant une cirrhose hépatique de stade Child-Pugh A et non éligibles en première intention à un traitement chirurgical ou locorégional ou après échec de ces traitements ;
– traitement du carcinome thyroïdien progressif, localement avancé ou métastatique, différencié (cancer papillaire/folliculaire/à cellules de Hürthle), réfractaire à l’iode radioactif.
Code CIP | Présentation |
|---|---|
34009 302 228 6 7 | SORAFENIB MEDIPHA 200 mg, comprimés pelliculés (B/112) (laboratoires MEDIPHA SANTE) |
34009 302 195 8 4 | SORAFENIB TEVA 200 mg, comprimés pelliculés (B/112) (laboratoires TEVA SANTE) |
2. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
Prévention des événements athérothrombotiques :
– chez les patients adultes souffrant d’un infarctus du myocarde (datant de quelques jours à moins de 35 jours), d’un accident vasculaire cérébral ischémique (datant de plus de 7 jours et de moins de 6 mois) ou d’une artériopathie oblitérante des membres inférieurs établie ;
– chez les patients adultes souffrant d’un syndrome coronaire aigu :
– syndrome coronaire aigu sans sus-décalage du segment ST (angor instable ou infarctus du myocarde sans onde Q), y compris les patients bénéficiant d’une angioplastie coronaire avec pose de stent, en association à l’acide acétylsalicylique (AAS) ;
– infarctus du myocarde aigu avec sus-décalage du segment ST, en association à l’AAS chez les patients traités médicalement et éligibles à un traitement thrombolytique.
Code CIP | Présentation |
|---|---|
34009 302 248 1 6 | CLOPIDOGREL BIOGARAN 75 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
3. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
– en remplacement de la prise séparée de tamsulosine et de dutastéride et à la condition que cette association ait été bien tolérée durant au moins 6 mois de traitement.
Code CIP | Présentation |
|---|---|
34009 301 885 6 9 | DUTASTERIDE/TAMSULOSINE SANDOZ 0,5 mg/0,4 mg, gélules en flacon (B/30) (laboratoires SANDOZ) |
4. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 246 1 8 | ATORVASTATINE BIOGARAN 10 mg, comprimés pelliculés en flacon (B/30) (laboratoires BIOGARAN) |
34009 302 246 3 2 | ATORVASTATINE BIOGARAN 20 mg, comprimés pelliculés en flacon (B/30) (laboratoires BIOGARAN) |
34009 302 246 4 9 | ATORVASTATINE BIOGARAN 40 mg, comprimés pelliculés en flacon (B/30) (laboratoires BIOGARAN) |
34009 302 201 2 2 | FENTANYL BIOGARAN 100 microgrammes, comprimés sublinguaux (B/10) (laboratoires BIOGARAN) |
34009 302 201 3 9 | FENTANYL BIOGARAN 100 microgrammes, comprimés sublinguaux (B/30) (laboratoires BIOGARAN) |
34009 302 201 4 6 | FENTANYL BIOGARAN 200 microgrammes, comprimés sublinguaux (B/10) (laboratoires BIOGARAN) |
34009 302 201 5 3 | FENTANYL BIOGARAN 200 microgrammes, comprimés sublinguaux (B/30) (laboratoires BIOGARAN) |
34009 302 201 6 0 | FENTANYL BIOGARAN 300 microgrammes, comprimés sublinguaux (B/10) (laboratoires BIOGARAN) |
34009 302 201 7 7 | FENTANYL BIOGARAN 300 microgrammes, comprimés sublinguaux (B/30) (laboratoires BIOGARAN) |
34009 302 201 8 4 | FENTANYL BIOGARAN 400 microgrammes, comprimés sublinguaux (B/10) (laboratoires BIOGARAN) |
34009 302 202 0 7 | FENTANYL BIOGARAN 400 microgrammes, comprimés sublinguaux (B/30) (laboratoires BIOGARAN) |
34009 302 202 3 8 | FENTANYL BIOGARAN 600 microgrammes, comprimés sublinguaux (B/30) (laboratoires BIOGARAN) |
34009 302 202 4 5 | FENTANYL BIOGARAN 800 microgrammes, comprimés sublinguaux (B/30) (laboratoires BIOGARAN) |
DEUXIÈME PARTIE
(5 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit :
Libellés abrogés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 216 620 7 8 | AMOROLFINE RANBAXY 5 %, vernis à ongles médicamenteux 2,5 ml en flacon avec 20 spatules (B/1) (Laboratoires RANBAXY PHARMACIE GENERIQUES) | 34009 216 620 7 8 | AMOROLFINE SUBSTIPHARM 5 %, vernis à ongles médicamenteux 2,5 ml en flacon avec 20 spatules (B/1) (Laboratoires SUBSTIPHARM) |
34009 300 023 0 8 | AMOROLFINE RANBAXY 5 %, vernis à ongles médicamenteux, 2,5 ml en flacon (verre type III) avec 20 spatules (B/1) (Laboratoires RANBAXY PHARMACIE GENERIQUES) | 34009 300 023 0 8 | AMOROLFINE SUBSTIPHARM 5 %, vernis à ongles médicamenteux, 2,5 ml en flacon (verre type III) avec 20 spatules (B/1) (Laboratoires SUBSTIPHARM) |
34009 300 482 1 4 | RASAGILINE HCS 1 mg, comprimés sous plaquette (OPA/Alu/PVC-Alu) (B/30) (Laboratoires HCS BVBA) | 34009 300 482 1 4 | RASAGILINE KRKA 1 mg, comprimés sous plaquette (OPA/Alu/PVC-Alu) (B/30) (Laboratoires KRKA FRANCE) |
34009 300 482 9 0 | RASAGILINE HCS 1 mg, comprimés sous plaquette (OPA/Alu/PVC-Alu) prédécoupée unitaire avec calendrier (B/30) (Laboratoires HCS BVBA) | 34009 300 482 9 0 | RASAGILINE KRKA 1 mg, comprimés sous plaquette (OPA/Alu/PVC-Alu) prédécoupée unitaire avec calendrier (B/30) (Laboratoires KRKA FRANCE) |
34009 300 482 5 2 | RASAGILINE HCS 1 mg, comprimés sous plaquette (OPA/Alu/PVC-Alu) prédécoupée unitaire (B/30) (Laboratoires HCS BVBA) | 34009 300 482 5 2 | RASAGILINE KRKA 1 mg, comprimés sous plaquette (OPA/Alu/PVC-Alu) prédécoupée unitaire (B/30) (Laboratoires KRKA FRANCE) |
JORF n°0102 du 30 avril 2021 Texte n° 63
Arrêté du 26 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
A l’annexe (première partie) de l’arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics (Journal officiel du 30 mars 2021 – NOR : SSAS2107740A, texte 26), le point 2 est remplacé par :
« Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté, à l’exception de l’indication :
– traitement de l’hyperparathyroïdie (HPT) secondaire chez les enfants âgés de 3 ans et plus, dialysés, atteints d’insuffisance rénale chronique terminale (IRCT) chez qui l’HPT secondaire n’est pas correctement contrôlée par les traitements de référence.
Code CIP | Présentation |
|---|---|
34009 301 722 2 3 | CINACALCET BGR 30 mg, comprimés pelliculés (B/28) (laboratoires BIOGARAN) |
34009 301 722 0 9 | CINACALCET BGR 60 mg, comprimés pelliculés (B/28) (laboratoires BIOGARAN) |
34009 301 721 7 9 | CINACALCET BGR 90 mg, comprimés pelliculés (B/28) (laboratoires BIOGARAN) |
A l’annexe de l’arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics (Journal officiel du 30 mars 2021 – NOR : SSAS2107740A, texte 26), la seconde partie (extension d’indication) est remplacée par :
« La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement des patients pédiatriques atteints de leucémie aiguë lymphoblastique à Chromosome Philadelphie (LAL Ph+) nouvellement diagnostiquée en association à une chimiothérapie.
Code CIP | Présentation |
|---|---|
34009 301 639 8 6 | DASATINIB SANDOZ 100 mg, comprimés pelliculés (B/30) (laboratoires SANDOZ) |
34009 301 639 2 4 | DASATINIB SANDOZ 140 mg, comprimés pelliculés (B/30) (laboratoires SANDOZ) |
34009 301 641 7 4 | DASATINIB SANDOZ 20 mg, comprimés pelliculés (B/60) (laboratoires SANDOZ) |
34009 301 641 3 6 | DASATINIB SANDOZ 50 mg, comprimés pelliculés (B/60) (laboratoires SANDOZ) |
34009 301 640 5 1 | DASATINIB SANDOZ 70 mg, comprimés pelliculés (B/60) (laboratoires SANDOZ) |
JORF n°0102 du 30 avril 2021 Texte n° 61
Arrêté du 22 avril 2021 modifiant l’arrêté du 17 novembre 2020 limitant l’utilisation de médicaments de thérapie génique indiqués dans le traitement des enfants atteints de déficit en décarboxylase des acides aminés aromatiques (AADC) à certains établissements de santé en application des dispositions de l’article L. 1151-1 du code de la santé publique
A l’article 2 de l’arrêté susvisé, les mots : « 30 avril 2021 » sont remplacés par les mots : « 31 octobre 2021 ».
JORF n°0102 du 30 avril 2021 Texte n° 60
Arrêté du 19 avril 2021 modifiant l’arrêté du 18 janvier 2021 portant modification des modalités de prise en charge des implants du rachis inscrits au chapitre 1er du titre III de la liste prévue à l’article L. 165-1 (LPP) du code de la sécurité sociale
L’article 2 de l’arrêté du 18 janvier 2021 susmentionné est remplacé par les dispositions suivantes :
« Art. 2. – Le présent arrêté entre en vigueur au 1er juillet 2021. »
JORF n°0102 du 30 avril 2021 Texte n° 59
Arrêté du 26 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
Polyarthrite rhumatoïde (adulte)
En association au méthotrexate, traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l’adulte lorsque la réponse aux traitements de fond, y compris le méthotrexate, est inadéquate.
ASMPARITY peut être donné en monothérapie en cas d’intolérance au méthotrexate ou lorsque la poursuite du traitement avec le méthotrexate est inadaptée.
Il a été montré qu’AMSPARITY ralentit la progression des dommages structuraux articulaires mesurés par radiographie et améliore les capacités fonctionnelles lorsqu’il est administré en association au méthotrexate.
Spondyloarthrite axiale (adulte)
Spondylarthrite ankylosante (SA) :
Traitement de la spondylarthrite ankylosante sévère et active chez l’adulte ayant eu une réponse inadéquate au traitement conventionnel.
Spondyloarthrite axiale sans signes radiographiques de SA :
Traitement de la spondyloarthrite axiale sévère sans signes radiographiques de SA, mais avec des signes objectifs d’inflammation à l’IRM et/ou un taux élevé de CRP chez les adultes ayant eu une réponse inadéquate ou une intolérance aux anti-inflammatoires non stéroïdiens.
Rhumatisme psoriasique (adulte)
Traitement du rhumatisme psoriasique actif et évolutif chez les adultes lorsque la réponse à un traitement de fond antérieur a été inadéquate. Il a été montré qu’AMSPARITY ralentit la progression des dommages structuraux articulaires périphériques tels que mesurés par radiographie, chez les patients ayant des formes polyarticulaires symétriques de la maladie et améliore les capacités fonctionnelles.
Arthrite juvénile idiopathique (enfant et adolescent)
Arthrite juvénile idiopathique polyarticulaire :
En association au méthotrexate : traitement de l’arthrite juvénile idiopathique polyarticulaire évolutive chez les patients à partir de 2 ans en cas de réponse insuffisante à un ou plusieurs traitements de fond.
AMSPARITY peut être administré en monothérapie en cas d’intolérance au méthotrexate ou lorsque la poursuite du traitement par le méthotrexate est inadaptée. AMSPARITY n’a pas été étudié chez l’enfant de moins de 2 ans.
Arthrite liée à l’enthésite :
Traitement de l’arthrite active liée à l’enthésite chez les patients à partir de 6 ans en cas de réponse insuffisante ou d’intolérance au traitement conventionnel.
Psoriasis en plaques (enfant, adolescent et l’adulte)
Traitement du psoriasis en plaques chronique sévère de l’enfant à partir de 4 ans, de l’adolescent et de l’adulte, défini par :
– un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie ;
– et une forme étendue et/ou un retentissement psychosocial important.
Maladie de Crohn (adulte)
Traitement de la maladie de Crohn active modérée à sévère, chez les patients adultes qui n’ont pas répondu malgré un traitement approprié et bien conduit par un corticoïde et/ou un immunosuppresseur ; ou chez lesquels ce traitement est contre-indiqué ou mal toléré.
Maladie de Crohn (enfant et adolescent)
Traitement de la maladie de Crohn active, sévère, chez les enfants et les adolescents âgés de 6 à 17 ans, qui n’ont pas répondu à un traitement conventionnel comprenant un corticoïde, un immunomodulateur et un traitement nutritionnel de première intention ; ou chez lesquels ces traitements sont mal tolérés ou contre-indiqués.
Rectocolite hémorragique (enfant, adolescent et adulte)
Traitement de la rectocolite hémorragique active, modérée à sévère chez les patients qui n’ont pas répondu de manière adéquate à un traitement conventionnel comprenant les corticoïdes et l’azathioprine ou la 6-mercaptopurine, ou chez lesquels ce traitement est mal toléré ou contre-indiqué.
Uvéite (adulte)
Traitement de l’uvéite non infectieuse, intermédiaire, postérieure et de la panuvéite chez les patients adultes ayant eu une réponse insuffisante à la corticothérapie, chez les patients nécessitant une épargne cortisonique, ou chez lesquels la corticothérapie est inappropriée.
Uvéite (enfant et adolescent)
En association au méthotrexate, traitement de l’uvéite antérieure chronique non infectieuse associée à une arthrite juvénile idiopathique chez l’enfant à partir de de 2 ans et l’adolescent, en cas de réponse insuffisante ou d’intolérance au traitement conventionnel ou pour lesquels un traitement conventionnel est inapproprié.
Code CIP | Présentation |
|---|---|
34009 302 163 2 3 | AMSPARITY 40 mg (adalimumab), solution injectable, 0,8 ml (40 mg/0,8 ml) en seringue préremplie (B/2) + 2 tampons d’alcool (laboratoires PFIZER) |
34009 302 163 3 0 | AMSPARITY 40 mg (adalimumab), solution injectable, 0,8 ml (40 mg/0,8 ml) en stylo prérempli (B/2) + 2 tampons d’alcool (laboratoires PFIZER) |
JORF n°0101 du 29 avril 2021 Texte n° 24
Arrêté du 26 avril 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 1, section 2 | 5154305, 5139719 | Systèmes de thrombo-aspiration |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0101 du 29 avril 2021 Texte n° 23
Arrêté du 26 avril 2021 portant inscription des cathéters pour systèmes de thrombo-aspiration SOFIA et SOFIA PLUS de la société MICROVENTION EUROPE au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0101 du 29 avril 2021 Texte n° 22
Arrêté du 26 avril 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005 susvisé, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 1, section 2 | 5141194 | Systèmes de thrombo-aspiration |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0101 du 29 avril 2021 Texte n° 21
Arrêté du 26 avril 2021 portant inscription des cathéters pour systèmes de thrombo-aspiration REACT de la société MEDTRONIC France au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0099 du 27 avril 2021 Texte n° 9
Arrêté du 22 avril 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, le code suivant est ajouté :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 1, section 1 | 5188735 | Stents retrievers |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0099 du 27 avril 2021 Texte n° 8
Arrêté du 22 avril 2021 portant inscription du stent retriever EMBOTRAP III de la société JOHNSON & JOHNSON MEDICAL au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0096 du 23 avril 2021 Texte n° 24
Arrêté du 19 avril 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont ajoutés :
«
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3152667, 3171630 | Implants vasculaires |
».
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0096 du 23 avril 2021 Texte n° 23
Arrêté du 19 avril 2021 portant inscription de l’endoprothèse aortique abdominale GORE EXCLUDER CONFORMABLE, renouvellement et modification des conditions d’inscription de l’endoprothèse aortique abdominale GORE EXCLUDER de la société W.L. GORE et Associés au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0096 du 23 avril 2021 Texte n° 22
Arrêté du 19 avril 2021 portant modification des conditions d’inscription du substitut osseux sur mesure pour reconstruction crânienne MEDPOR CCI de la société STRYKER France inscrit au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0096 du 23 avril 2021 Texte n° 21
Arrêté du 19 avril 2021 portant renouvellement d’inscription des systèmes d’implants cochléaires NUCLEUS de la société COCHLEAR France inscrit au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables, chapitre 4, section 12, sous-section 1 « Systèmes d’implants cochléaires » dans la rubrique « Société Cochlear France SAS (COCHLEAR) », la date de fin de prise en charge du code 3446720 est portée au 28 février 2024.
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0096 du 23 avril 2021 Texte n° 20
Arrêté du 17 avril 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée pour les spécialités ci-dessous ainsi qu’il suit :
1. Au 1 « Médicaments dérivés du sang » :
a) Les spécialités suivantes sont radiées :
NOM DE LA SPÉCIALITÉ | EXPLOITANT OU TITULAIRE | CODE UCD | DÉNOMINATION |
|---|---|---|---|
BENEFIX 250 UI, poudre et solvant pour solution injectable | BAXTER | 9200999 | BENEFIX 250 UI INJ FL+FL. |
BENEFIX 500 UI, poudre et solvant pour solution injectable | BAXTER | 9201007 | BENEFIX 500 UI INJ FL+FL. |
BENEFIX 1 000 UI, poudre et solvant pour solution injectable | BAXTER | 9200982 | BENEFIX 1 000 UI INJ FL+FL. |
b) Le libellé des spécialités pharmaceutiques suivantes est modifié :
LIBELLÉS ABROGÉS | |||
|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT OU TITULAIRE | CODE UCD | DÉNOMINATION |
BENEFIX 250 UI, poudre et solvant pour solution injectable. | WYETH PHARMACEUTICALS FRANCE. | 9304279 | BENEFIX 250 UI INJ FL+SRG |
BENEFIX 500 UI, poudre et solvant pour solution injectable. | WYETH PHARMACEUTICALS FRANCE. | 9304285 | BENEFIX 500 UI INJ FL+SRG |
BENEFIX 1 000 UI, poudre et solvant pour solution injectable. | WYETH PHARMACEUTICALS FRANCE. | 9304256 | BENEFIX 1 000 UI INJ FL+SRG |
BENEFIX 2 000 UI, poudre et solvant pour solution injectable. | WYETH PHARMACEUTICALS FRANCE. | 9304262 | BENEFIX 2 000 UI INJ FL+SRG |
NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
BENEFIX 250 UI, poudre et solvant pour solution injectable. | PFIZER | 6 542 473 7 | 9304279 | BENEFIX 250UI INJ FL+SRG |
BENEFIX 500 UI, poudre et solvant pour solution injectable. | PFIZER | 6 161 301 4 | 9304285 | BENEFIX 500UI INJ FL+SRG |
BENEFIX 1 000 UI, poudre et solvant pour solution injectable. | PFIZER | 6 208 455 3 | 9304256 | BENEFIX 1000UI INJ FL+SRG |
BENEFIX 2 000 UI, poudre et solvant pour solution injectable. | PFIZER | 6 396 505 3 | 9304262 | BENEFIX 2000UI INJ FL+SRG |
2. Au 2 « Antirétroviraux », le libellé des spécialités pharmaceutiques suivantes est modifié :
LIBELLÉS ABROGÉS | |||
|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT OU TITULAIRE | CODE UCD | DÉNOMINATION |
CELSENTRI 150 mg, comprimé pelliculé. | PFIZER | 9317276 | CELSENTRI 150 MG CPR |
CELSENTRI 300 mg, comprimé pelliculé. | PFIZER | 9317282 | CELSENTRI 300 MG CPR |
NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
CELSENTRI 150 mg, comprimé pelliculé. | VIIV HEALTHCARE FRANCE | 6 209 436 2 | 9317276 | CELSENTRI 150MG CPR |
CELSENTRI 300 mg, comprimé pelliculé. | VIIV HEALTHCARE FRANCE | 6 118 272 4 | 9317282 | CELSENTRI 300MG CPR |
3. Au 4 « Antibiotiques » :
a) Les spécialités suivantes sont radiées :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
|---|---|---|---|---|
CEFOXITINE HOSPIRA 1 g poudre pour solution injectable (IV) | HOSPIRA FRANCE | 6 551 355 2 | 9335498 | CEFOXITINE HPI 1G INJ |
CEFOXITINE HOSPIRA 2 g poudre pour solution injectable (IV) | HOSPIRA FRANCE | 6 454 691 6 | 9335506 | CEFOXITINE HPI 2G INJ |
b) Le libellé des spécialités pharmaceutiques suivantes est modifié :
LIBELLÉS ABROGÉS | ||||
|---|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
ZYVOXID 600 mg, comprimé pelliculé | PFIZER PFE FRANCE | 6 831 127 8 | 9233533 | ZYVOXID 600MG CPR |
ZYVOXID 2mg/ml, solution pour perfusion | PFIZER PFE FRANCE | 6 328 309 5 | 9386946 | ZYVOXID 2MG/ML INJ PFX300ML |
NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
ZYVOXID 600 mg, comprimé pelliculé | PFIZER | 6 831 127 8 | 9233533 | ZYVOXID 600MG CPR |
ZYVOXID 2mg/ml, solution pour perfusion | PFIZER | 6 328 309 5 | 9386946 | ZYVOXID 2MG/ML INJ PFX300ML |
4. Au 6 « Antifongiques », le libellé des spécialités pharmaceutiques suivantes est modifié :
LIBELLÉS ABROGÉS | ||||
|---|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
CRESEMBA 100 mg, gélule | PFIZER PFE FRANCE | 6 918 104 0 | 9416995 | CRESEMBA 100MG GELU |
CRESEMBA 200 mg, poudre pour solution à diluer pour perfusion | PFIZER PFE FRANCE | 6 018 459 0 | 9417003 | CRESEMBA 200MG INJ FL |
NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
CRESEMBA 100 mg, gélule | PFIZER | 6 918 104 0 | 9416995 | CRESEMBA 100MG GELU |
CRESEMBA 200 mg, poudre pour solution à diluer pour perfusion | PFIZER | 6 018 459 0 | 9417003 | CRESEMBA 200MG INJ FL |
5. Au 8 « Médicaments bénéficiant d’une autorisation temporaire d’utilisation de cohorte », les spécialités suivantes sont radiées :
NOM DE LA SPÉCIALITÉ | EXPLOITANT | CODE UCD | DENOMINATION |
|---|---|---|---|
LORVIQUA 25 mg, comprimé pelliculé | PFIZER | 9446016 | LORVIQUA 25MG CPR |
LORVIQUA 100 mg, comprimé pelliculé | PFIZER | 9445991 | LORVIQUA 100MG CPR |
PALBOCICLIB 75 mg, gélule | PFIZER | 9407677 | PALBOCICLIB PFZ 75MG GELU |
PALBOCICLIB 100 mg, gélule | PFIZER | 9407654 | PALBOCICLIB PFZ 100MG GELU |
PALBOCICLIB 125 mg, gélule | PFIZER | 9407660 | PALBOCICLIB PFZ 125MG GELU |
JORF n°0096 du 23 avril 2021 Texte n° 19
Arrêté du 13 avril 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes, pour lesquelles la participation de l’assuré est fixée par l’Union nationale des caisses d’assurance maladie (UNCAM), sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie, pour les spécialités visées ci-dessous, sont celles qui figurent à l’autorisation de mise sur le marché à la date du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 943 247 4 4 | CASPOFUNGINE SUN 50MG PERF FL | SUN PHARMACEUTICALS INDUSTRIES EUROPE BV |
| 34008 943 248 0 5 | CASPOFUNGINE SUN 70MG PERF FL | SUN PHARMACEUTICALS INDUSTRIES EUROPE BV |
JORF n°0094 du 21 avril 2021 Texte n° 13
Arrêté du 16 avril 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
a) A l’annexe de l’arrêté du 2 mars 2005 susvisé, à la fin de la liste, après la référence « Titre III, chapitre 4, section 15 », est créée une nouvelle rubrique ainsi libellée :
«
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 4, section 16 | Enveloppe antibactérienne résorbable |
» ;
b) A l’annexe de l’arrêté du 2 mars 2005, dans la nouvelle rubrique, le code suivant est ajouté :
«
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 4, section 16 | 3412370 | Enveloppe antibactérienne résorbable |
».
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0094 du 21 avril 2021 Texte n° 12
Arrêté du 16 avril 2021 portant inscription de l’enveloppe antibactérienne résorbable TYRX de la société MEDTRONIC France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables, chapitre 4, est créée la section suivante :
CODE | NOMENCLATURE |
|---|---|
Section 16 Enveloppe antibactérienne résorbable | |
Société MEDTRONIC France (MEDTRONIC) | |
3412370 | Enveloppe antibactérienne résorbable, stimulateur, défibrillateur, MEDTRONIC, TYRX Enveloppe antibactérienne résorbable pour stimulateur et défibrillateur cardiaque implantable TYRX de la société MEDTRONIC France. DESCRIPTION L’enveloppe antibactérienne résorbable TYRX est composée d’un substrat en treillis totalement résorbable, d’un revêtement polymère résorbable et de deux antibiotiques (minocycline et la rifampicine). INDICATIONS : Prévention du risque d’infection liée à l’implantation de prothèse rythmique cardiaque, chez les patients dans les situations à haut risque d’infection suivantes : – procédure de remplacement, révision ou upgrade de stimulateurs cardiaques ou défibrillateurs cardiaques simple, double ou triple chambre ; – primo-implantation de défibrillateur cardiaque triple chambre (CRT-D). MODALITÉS DE PRESCRIPTION ET D’UTILISATION L’utilisation de l’enveloppe antibactérienne résorbable TYRX ne modifie pas les modalités d’utilisation et de prescription des prothèses rythmiques cardiaques implantables. Une seule enveloppe TYRX est nécessaire par intervention. RÉFÉRENCES PRISES EN CHARGE : – CMRM6122INT : 6,3 cm × 6,9 cm – CMRM6133INT : 7,4 cm × 8,5 cm Date de fin de prise en charge : 30 avril 2026. |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0093 du 20 avril 2021 Texte n° 77
Arrêté du 16 avril 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont ajoutés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 4, section 11 | 3420910, 3408428 | Système de stimulation cérébrale profonde bilatérale ou unilatérale |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0093 du 20 avril 2021 Texte n° 76
Arrêté du 16 avril 2021 portant inscription du système non rechargeable double canal pour stimulation cérébrale profonde (SCP) PERCEPT PC de la société MEDTRONIC France au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0093 du 20 avril 2021 Texte n° 75
Arrêté du 16 avril 2021 portant renouvellement d’inscription et modification des conditions d’inscription du système rechargeable double canal pour stimulation cérébrale profonde ACTIVA RC, du système non rechargeable simple canal pour stimulation cérébrale profonde ACTIVA SC, système non rechargeable double canal pour stimulation cérébrale profonde ACTIVA PC de la société MEDTRONIC France inscrits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0093 du 20 avril 2021 Texte n° 74
Arrêté du 15 avril 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Adulte, adolescent d’âge ≥ 16 ans et personnes âgées :
– traitement de la candidose invasive ;
– traitement de la candidose œsophagienne chez les patients pour lesquels un traitement intraveineux est approprié ;
– prévention des infections à Candida chez les patients bénéficiant d’une allogreffe de cellules souches hématopoïétiques ou chez les patients chez qui une neutropénie est attendue (taux absolu de neutrophiles < 500 cellules/μl) pendant au moins 10 jours.
– Enfant (y compris nouveau-né) et l’adolescent < 16 ans :
– traitement de la candidose invasive ;
– prévention des infections à Candida chez les patients bénéficiant d’une allogreffe de cellules souches hématopoïétiques ou chez les patients chez qui une neutropénie est attendue (taux absolu de neutrophiles < 500 cellules / µl) pendant au moins 10 jours.
La décision d’utiliser MICAFUNGINE HIKMA doit tenir compte du risque potentiel de développement de tumeurs hépatiques. Ainsi, MICAFUNGINE HIKMA ne doit être utilisée que si l’administration d’autres antifongiques n’est pas appropriée. Il convient de tenir compte des recommandations officielles/nationales concernant l’utilisation appropriée des antifongiques.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
MICAFUNGINE | MICAFUNGINE HIKMA 100 mg, poudre pour solution à diluer pour perfusion | 3400890009768 | MICAFUNGINE HIK 100MG PERF FL | DELBERT |
MICAFUNGINE | MICAFUNGINE HIKMA 50 mg, poudre pour solution à diluer pour perfusion | 3400890009775 | MICAFUNGINE HIK 50MG PERF FL | DELBERT |
JORF n°0093 du 20 avril 2021 Texte n° 73
Arrêté du 15 avril 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Mésothéliome pleural malin : en association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure ;
– Cancer bronchique non à petites cellules :
– en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde ;
– en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé ;
– en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
pemetrexed | PEMETREXED ACCORD 25 mg/ml, solution à diluer pour perfusion | 3400890009850 | PEMETREXED ACC 25MG/ML FL20ML | ACCORD HEALTHCARE FRANCE SAS |
pemetrexed | PEMETREXED ACCORD 25 mg/ml, solution à diluer pour perfusion | 3400890009867 | PEMETREXED ACC 25MG/ML FL34ML | ACCORD HEALTHCARE FRANCE SAS |
pemetrexed | PEMETREXED ACCORD 25 mg/ml, solution à diluer pour perfusion | 3400890009898 | PEMETREXED ACC 25MG/ML FL40ML | ACCORD HEALTHCARE FRANCE SAS |
pemetrexed | PEMETREXED ACCORD 25 mg/ml, solution à diluer pour perfusion | 3400890009881 | PEMETREXED ACC 25MG/ML FL4ML | ACCORD HEALTHCARE FRANCE SAS |
JORF n°0093 du 20 avril 2021 Texte n° 72
Arrêté du 15 avril 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La spécialité pharmaceutique suivante est inscrite sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour la spécialité visée ci-dessous :
– Mésothéliome pleural malin : en association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure ;
– Cancer bronchique non à petites cellules :
– en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde ;
– en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé ;
– en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
pemetrexed | PEMETREXED REDDY PHARMA 1000 mg, poudre pour solution à diluer pour perfusion | 3400890009980 | PEMETREXED RYP 1000MG PERF FL | REDDY PHARMA SAS |
JORF n°0093 du 20 avril 2021 Texte n° 71
Arrêté du 15 avril 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Mésothéliome pleural malin : en association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure ;
– Cancer bronchique non à petites cellules :
– en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde ;
– en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé ;
– en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
pemetrexed | PEMETREXED EG 25 mg-ml, solution à diluer pour perfusion | 3400890009010 | PEMETREXED EG 25MG/ML FL20ML | EG LABO – LABORATOIRES EUROGENERICS |
pemetrexed | PEMETREXED EG 25 mg-ml, solution à diluer pour perfusion | 3400890009034 | PEMETREXED EG 25MG/ML FL40ML | EG LABO – LABORATOIRES EUROGENERICS |
pemetrexed | PEMETREXED EG 25 mg-ml, solution à diluer pour perfusion | 3400890009027 | PEMETREXED EG 25MG/ML FL4ML | EG LABO – LABORATOIRES EUROGENERICS |
JORF n°0093 du 20 avril 2021 Texte n° 70
Arrêté du 15 avril 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Les spécialités suivantes sont inscrites sur la liste des spécialités pharmaceutiques facturables en sus des prestations d’hospitalisation visée à l’article L. 162-22-7 du code de la sécurité sociale.
Les seules indications thérapeutiques ouvrant droit à la prise en charge en sus par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Mésothéliome pleural malin : en association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure.
– Cancer bronchique non à petites cellules :
– en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde ;
– en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé ;
– en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
pemetrexed | PEMETREXED EVER PHARMA 25 mg/mL, solution à diluer pour perfusion | 3400890008969 | PEMETREXED ERP 25MG/ML FL20ML1 | EVER PHARMA FRANCE |
pemetrexed | PEMETREXED EVER PHARMA 25 mg/mL, solution à diluer pour perfusion | 3400890008990 | PEMETREXED ERP 25MG/ML FL40ML1 | EVER PHARMA FRANCE |
pemetrexed | PEMETREXED EVER PHARMA 25 mg/mL, solution à diluer pour perfusion | 3400890008976 | PEMETREXED ERP 25MG/ML FL4ML 1 | EVER PHARMA FRANCE |
JORF n°0093 du 20 avril 2021 Texte n° 68
Arrêté du 13 avril 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie et à la suppression de la participation de l’assuré sont celles qui figurent dans l’autorisation de mise sur le marché à la date de la publication du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 098 5 0 | PEMETREXED ACC 25MG/ML FL20ML | ACCORD HEALTHCARE FRANCE SAS |
| 34008 900 098 6 7 | PEMETREXED ACC 25MG/ML FL34ML | ACCORD HEALTHCARE FRANCE SAS |
| 34008 900 098 9 8 | PEMETREXED ACC 25MG/ML FL40ML | ACCORD HEALTHCARE FRANCE SAS |
| 34008 900 098 8 1 | PEMETREXED ACC 25MG/ML FL4ML | ACCORD HEALTHCARE FRANCE SAS |
| 34008 900 090 1 0 | PEMETREXED EG 25MG/ML FL20ML | EG LABO LABORATOIRES EUROGENERICS |
| 34008 900 090 3 4 | PEMETREXED EG 25MG/ML FL40ML | EG LABO LABORATOIRES EUROGENERICS |
| 34008 900 090 2 7 | PEMETREXED EG 25MG/ML FL4ML | EG LABO LABORATOIRES EUROGENERICS |
JORF n°0093 du 20 avril 2021 Texte n° 67
Arrêté du 13 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 207 6 4 | PEMETREXED ACCORD 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 20 ml (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 207 8 8 | PEMETREXED ACCORD 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 34 ml (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 207 9 5 | PEMETREXED ACCORD 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 40 ml (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 207 5 7 | PEMETREXED ACCORD 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 4 ml (B/1) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 550 266 4 8 | PEMETREXED EG 25 mg/ml, solution à diluer pour perfusion, flacon de 20 ml (B/1) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 550 653 5 7 | PEMETREXED EG 25 mg/ml, solution à diluer pour perfusion, flacon de 40 ml (B/1) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 550 216 3 6 | PEMETREXED EG 25 mg/ml, solution à diluer pour perfusion, flacon de 4 ml (B/1) (laboratoires EG LABO LABORATOIRES EUROGENERICS) |
JORF n°0093 du 20 avril 2021 Texte n° 66
Arrêté du 13 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 550 781 1 1 | MICAFUNGINE HIKMA 100 mg, poudre pour solution à diluer pour perfusion, flacon (verre) de 10 ml (B/1) (laboratoires DELBERT) |
34009 550 780 7 4 | MICAFUNGINE HIKMA 50 mg, poudre pour solution à diluer pour perfusion, flacon (verre) de 10 ml (B/1) (laboratoires DELBERT) |
JORF n°0093 du 20 avril 2021 Texte n° 65
Arrêté du 13 avril 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes, pour lesquelles la participation de l’assuré est fixée par l’Union nationale des caisses d’assurance maladie (UNCAM), sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie, pour les spécialités visées ci-dessous, sont celles qui figurent à l’autorisation de mise sur le marché à la date du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 900 097 6 8 | MICAFUNGINE HIK 100MG PERF FL1 | DELBERT |
| 34008 900 097 7 5 | MICAFUNGINE HIK 50MG PERF FL 1 | DELBERT |
JORF n°0093 du 20 avril 2021 Texte n° 63
Arrêté du 13 avril 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie et à la suppression de la participation de l’assuré sont celles qui figurent dans l’autorisation de mise sur le marché à la date de la publication du présent arrêté.
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 900 089 6 9 | PEMETREXED ERP 25MG/ML FL20ML | EVER PHARMA FRANCE |
34008 900 089 9 0 | PEMETREXED ERP 25MG/ML FL40ML | EVER PHARMA FRANCE |
34008 900 089 7 6 | PEMETREXED ERP 25MG/ML FL4ML | EVER PHARMA FRANCE |
JORF n°0093 du 20 avril 2021 Texte n° 62
Arrêté du 13 avril 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La spécialité pharmaceutique rétrocédable suivante est prise en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie et à la suppression de la participation de l’assuré sont celles qui figurent dans l’autorisation de mise sur le marché à la date de la publication du présent arrêté.
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 900 099 8 0 | PEMETREXED RYP 1000MG PERF FL | REDDY PHARMA SAS |
JORF n°0093 du 20 avril 2021 Texte n° 61
Arrêté du 13 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 550 781 6 6 | PEMETREXED EVER PHARMA 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 20 ml (B/1) (laboratoires EVER PHARMA FRANCE) |
34009 550 781 7 3 | PEMETREXED EVER PHARMA 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 40 ml (B/1) (laboratoires EVER PHARMA FRANCE) |
34009 550 781 4 2 | PEMETREXED EVER PHARMA 25 mg/ml, solution à diluer pour perfusion, flacon (verre) de 4 ml (B/1) (laboratoires EVER PHARMA FRANCE) |
JORF n°0093 du 20 avril 2021 Texte n° 60
Arrêté du 13 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 278 491 6 9 | ADEMPAS 0,5 mg (riociguat), comprimés pelliculés, plaquette thermoformée (PP/alu) (B/84) (laboratoires MSD FRANCE) |
34009 278 497 4 9 | ADEMPAS 1,5 mg (riociguat), comprimés pelliculés, plaquette thermoformée (PP/alu) (B/84) (laboratoires MSD FRANCE) |
34009 278 494 5 9 | ADEMPAS 1 mg (riociguat), comprimés pelliculés, plaquette thermoformée (PP/alu) (B/84) (laboratoires MSD FRANCE) |
34009 278 503 4 9 | ADEMPAS 2,5 mg (riociguat), comprimés pelliculés, plaquette thermoformée (PP/alu) (B/84) (laboratoires MSD FRANCE) |
34009 278 500 5 9 | ADEMPAS 2 mg (riociguat), comprimés pelliculés, plaquette thermoformée (PP/alu) (B/84) (laboratoires MSD FRANCE) |
34009 301 585 4 8 | FOLINATE DE CALCIUM HIKMA 10 mg/mL, solution injectable/pour perfusion, 10 ml de solution injectable / pour perfusion en flacon (verre) (B/1) (laboratoires DELBERT) |
34009 301 585 5 5 | FOLINATE DE CALCIUM HIKMA 10 mg/mL, solution injectable/pour perfusion, 30 ml de solution injectable / pour perfusion en flacon (verre) (B/1) (laboratoires DELBERT) |
34009 301 585 6 2 | FOLINATE DE CALCIUM HIKMA 10 mg/mL, solution injectable/pour perfusion, 50 ml de solution injectable / pour perfusion en flacon (verre) (B/1) (laboratoires DELBERT) |
34009 301 585 3 1 | FOLINATE DE CALCIUM HIKMA 10 mg/mL, solution injectable/pour perfusion, 5 ml de solution injectable / pour perfusion en flacon (verre) (B/1) (laboratoires DELBERT) |
34009 550 707 8 8 | VERASEAL (fibrinogène humain / thrombine humaine), solutions pour colle, seringue pré-remplie (en verre), fibrinogène humain : 1 ml, thrombine humaine : 1 ml, boîte de 1 porte-seringue avec 2 seringues pré-remplies + 1 canule (laboratoires JOHNSON & JOHNSON MEDICAL SAS) |
34009 550 707 9 5 | VERASEAL (fibrinogène humain / thrombine humaine), solutions pour colle, seringue pré-remplie (en verre), fibrinogène humain : 2 ml, thrombine humaine : 2 ml, boîte de 1 porte-seringue avec 2 seringues pré-remplies + 1 canule (laboratoires JOHNSON & JOHNSON MEDICAL SAS) |
34009 550 708 0 1 | VERASEAL (fibrinogène humain / thrombine humaine), solutions pour colle, seringue pré-remplie (en verre), fibrinogène humain : 3 ml, thrombine humaine : 3 ml, boîte de 1 porte-seringue avec 2 seringues pré-remplies + 1 canule (laboratoires JOHNSON & JOHNSON MEDICAL SAS) |
34009 550 708 1 8 | VERASEAL (fibrinogène humain / thrombine humaine), solutions pour colle, seringue pré-remplie (en verre), fibrinogène humain : 5 ml, thrombine humaine : 5 ml, boîte de 1 porte-seringue avec 2 seringues pré-remplies + 1 canule (laboratoires JOHNSON & JOHNSON MEDICAL SAS) |
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, dans le traitement des infections suivantes :
– chez l’adulte présentant des infections compliquées de la peau et des tissus mous (IcPTM) ;
– chez l’adulte présentant une endocardite infectieuse (EI) du cœur droit due à Staphylococcus aureus ;
– chez l’adulte présentant une bactériémie à Staphylococcus aureus (BSA) lorsqu’elle est associée à une endocardite infectieuse (EI) du cœur droit ou à une infection compliquée de la peau et des tissus mous (IcPTM).
La daptomycine est efficace uniquement sur les bactéries à Gram positif (voir rubrique 5.1 du RCP). En cas d’infection mixtes polymicrobiennes pouvant comporter des bactéries à Gram négatif et/ou certains types de bactéries anaérobies, DAPTOMYCINE HOSPIRA doit être associé à un ou plusieurs antibactérien(s) adapté(s).
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des antibactériens.
Code CIP | Présentation |
|---|---|
34009 550 314 3 7 | DAPTOMYCINE HOSPIRA 350 mg, poudre pour solution injectable / pour perfusion, flacon (verre) (B/1) (laboratoires HOSPIRA FRANCE) |
34009 550 314 6 8 | DAPTOMYCINE HOSPIRA 350 mg, poudre pour solution injectable / pour perfusion, flacon (verre) (B/5) (laboratoires HOSPIRA FRANCE) |
34009 550 314 4 4 | DAPTOMYCINE HOSPIRA 500 mg, poudre pour solution injectable / pour perfusion, flacon (verre) (B/1) (laboratoires HOSPIRA FRANCE) |
34009 550 314 5 1 | DAPTOMYCINE HOSPIRA 500 mg, poudre pour solution injectable / pour perfusion, flacon (verre) (B/5) (laboratoires HOSPIRA FRANCE) |
(1 extension d’indication)
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– comme conditionnement avant une greffe autologue de cellules souches hématopoïétiques (CSH) en cas de malignités hématologiques (maladie de Hodgkin/lymphome non hodgkinien).
Code CIP | Présentation |
|---|---|
34009 550 674 9 8 | CARMUSTINE OBVIUS 100 mg, poudre et solvant pour solution pour perfusion, poudre : 100 mg en flacon (verre) ; solvant : 3 ml en ampoule (verre), boîte de 1 flacon + 1 ampoule (B/1) (laboratoires MEDAC SAS) |
JORF n°0093 du 20 avril 2021 Texte n° 59
Arrêté du 13 avril 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
Les spécialités pharmaceutiques rétrocédables suivantes, pour lesquelles la participation de l’assuré est fixée par l’Union nationale des caisses d’assurance maladie (UNCAM), sont prises en charge par l’Assurance Maladie.
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l’assurance maladie, pour les spécialités visées ci-dessous, sont celles qui figurent à l’autorisation de mise sur le marché à la date du présent arrêté.
| Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
| 34008 944 381 6 8 | ENTECAVIR HCS 0,5MG CPR | KRKA FRANCE |
| 34008 944 382 2 9 | ENTECAVIR HCS 1MG CPR | KRKA FRANCE |
JORF n°0093 du 20 avril 2021 Texte n° 58
Arrêté du 23 février 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 205 9 7 | PEMETREXED REDDY PHARMA 1 000 mg, poudre pour solution à diluer pour perfusion, poudre en flacon (verre) (B/1) (laboratoires REDDY PHARMA SAS) |
JORF n°0090 du 16 avril 2021 Texte n° 29
Arrêté du 12 avril 2021 portant changement de distributeur des endoprothèses coronaires à libération de sirolimus YUKON CHOICE PC et YUKON CHROME PC de la société TRANSLUMINA GmbH inscrites au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0090 du 16 avril 2021 Texte n° 27
Arrêté du 6 avril 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée pour les spécialités ci-dessous ainsi qu’il suit :
Au 6 « Autres médicaments », les libellés des spécialités pharmaceutiques suivantes sont modifiés :
| LIBELLÉS ABROGÉS | |||
|---|---|---|---|
| NOM DE LA SPECIALITÉ | EXPLOITANT OU TITULAIRE | CODE UCD | DÉNOMINATION |
| REVATIO 20 mg, comprimé pelliculé | PFIZER | 9279972 | REVATIO 20 MG CPR |
| NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
| NOM DE LA SPECIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
| REVATIO 20 mg, comprimé pelliculé | PFIZER PFE FRANCE | 6 815 595 0 | 9279972 | REVATIO 20MG CPR |
| LIBELLÉS ABROGÉS | |||
|---|---|---|---|
| NOM DE LA SPECIALITÉ | EXPLOITANT ou titulaire | CODE CIS | DÉNOMINATION |
| REVATIO 10 mg/ml, poudre pour suspension buvable | PFIZER | 6 171 811 1 | REVATIO 10 mg/ml, poudre pour suspension buvable – flacon verre |
| NOUVEAUX LIBELLÉS | ||||
|---|---|---|---|---|
| NOM DE LA SPECIALITÉ | EXPLOITANT | CODE CIS | CODE UCD | DÉNOMINATION |
| REVATIO 10 mg/ml, poudre pour suspension buvable | PFIZER PFE FRANCE | 6 171 811 1 | 9385013 | REVATIO 10MG/ML BUV FL |
JORF n°0090 du 16 avril 2021 Texte n° 26
Arrêté du 6 avril 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique (liste des spécialités rétrocédables)
L’annexe à l’arrêté du 17 décembre 2004 susvisé est modifiée ainsi qu’il suit :
Au 8 « Médicaments bénéficiant d’une autorisation temporaire d’utilisation de cohorte », la spécialité suivante est ajoutée :
«
| NOM DE LA SPECIALITE | EXPLOITANT | CODE UCD | DENOMINATION |
|---|---|---|---|
| RIVAROXABAN 1 mg/ml, suspension buvable | BAYER HEALTHCARE SAS | 9000432 | RIVAROXABAN BHC 1MG/ML BUV FL |
JORF n°0088 du 14 avril 2021 Texte n° 32
Arrêté du 12 avril 2021 portant modification des conditions d’inscription du cotyle monobloc sans ciment en polyéthylène hautement réticulé RM PRESSFIT VITAMYS de la société MATHYS ORTHOPEDIE S.A.S inscrit au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0088 du 14 avril 2021 Texte n° 29
Arrêté du 7 avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue dans l’indication suivante :
– en association avec le bortézomib, le thalidomide et la dexaméthasone pour le traitement des patients adultes atteints d’un myélome multiple nouvellement diagnostiqué et éligibles à une autogreffe de cellules souches.
Code CIP | Présentation |
|---|---|
34009 302 122 0 2 | DARZALEX 1 800 mg (daratumumab), solution injectable, flacon (verre) de 15 ml (120 mg/ml) (B/1) (laboratoires JANSSEN-CILAG) |
34009 550 218 1 0 | DARZALEX 20 mg/ml (daratumumab), solution à diluer pour perfusion, flacon (verre) de 20 ml (B/1) (laboratoires JANSSEN-CILAG) |
34009 550 218 0 3 | DARZALEX 20 mg/ml (daratumumab), solution à diluer pour perfusion, flacon (verre) de 5 ml (B/1) (laboratoires JANSSEN-CILAG) |
JORF n°0088 du 14 avril 2021 Texte n° 28
Arrêté du 7 avril 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La prise en charge en sus des prestations d’hospitalisation des spécialités ci-dessous est étendue à l’indication suivante :
– en association avec le bortézomib, le thalidomide et la dexaméthasone pour le traitement des patients adultes atteints d’un myélome multiple nouvellement diagnostiqué et éligibles à une autogreffe de cellules souches.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
daratumumab | DARZALEX 20 mg/mL solution à diluer pour perfusion | 3400894178712 | DARZALEX 20MG/ML PERF FL20ML | JANSSEN-CILAG |
daratumumab | DARZALEX 20 mg/mL solution à diluer pour perfusion | 3400894178880 | DARZALEX 20MG/ML PERF FL5ML | JANSSEN-CILAG |
daratumumab | DARZALEX 1800 mg, solution injectable | 3400890006576 | DARZALEX 1800MG INJ FV15ML | JANSSEN CILAG |
JORF n°0088 du 14 avril 2021 Texte n° 27
Arrêté du 7 avril 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
Dans l’annexe de l’arrêté du 24 février 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale publié le 2 mars 2021 (NOR : SSAS2017511A, texte n° 12) relatif à la spécialité DARZALEX 20 mg/mL solution à diluer pour perfusion, les mots :
« – en association avec le bortézomib, le thalidomide et la dexaméthasone pour le traitement des patients adultes atteints d’un myélome multiple nouvellement diagnostiqué et éligibles à une autogreffe de cellules souches. »
sont remplacés par les mots :
« – en association avec le bortézomib, le melphalan et la prednisone pour le traitement des patients adultes atteints d’un myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches. »
Dans l’annexe de l’arrêté du 24 février 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale publié le 2 mars 2021 (NOR : SSAS2026848A, texte n° 13) relatif à la spécialité DARZALEX 1800 mg, solution injectable, les mots :
« – en association avec le bortézomib, le thalidomide et la dexaméthasone pour le traitement des patients adultes atteints d’un myélome multiple nouvellement diagnostiqué et éligibles à une autogreffe de cellules souches »
sont remplacés par les mots :
« – en association avec le bortézomib, le melphalan et la prednisone pour le traitement des patients adultes atteints d’un myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches ».
JORF n°0087 du 13 avril 2021 Texte n° 25
Arrêté du 7 avril 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
A l’annexe de l’arrêté du 2 mars 2005, les codes suivants sont radiés :
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre III, chapitre 1, section 1, sous-section 2 | 3135396, 3113816, 3150160, 3114282, 3130542, 3154100, 3117872, 3123772, 3117040, 3161212, 3136651, 3102860, 3193169, 3107141, 3112219, 3186815, 3179985, 3159965 | Implants vasculaires |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0087 du 13 avril 2021 Texte n° 24
Arrêté du 7 avril 2021 portant radiation de produits au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale, au chapitre 1er, section 1, sous-section 2, paragraphe 3-B : « Endoprothèse coronaire dite “stent” à libération (lib.) contrôlée (LC) de principe actif », dans les rubriques « e » et « f » :
a) Le titre des rubriques « e » et « f » est ainsi modifié :
– « e) BIOMATRIX ALPHA » ;
– « f) BIOFREEDOM » ;
b) Dans ces rubriques, le titre « Société CARDINAL HEALTH France (CARDINAL) » et les codes suivants sont radiés :
CODE | LIBELLÉ |
|---|---|
3135396 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO ALPHA, 2,25 mm. |
3113816 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO ALPHA, 2,5 mm. |
3150160 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO ALPHA, 2,75 mm. |
3114282 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO ALPHA, 3,0 mm |
3130542 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO ALPHA, 3,5 mm. |
3154100 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO ALPHA, 4,0 mm. |
3117872 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FLEX, 2,25 mm. |
3123772 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FLEX, 2,5 mm. |
3117040 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FLEX, 2,75 mm. |
3161212 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FLEX, 3,0 mm. |
3136651 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FLEX, 3,5 mm. |
3102860 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FLEX, 4,0 mm. |
3193169 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FREE, DIAM 2,25mm. |
3107141 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FREE, DIAM 2,5mm. |
3112219 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FREE, DIAM 2,75mm. |
3186815 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FREE, DIAM 3,0mm. |
3179985 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FREE, DIAM 3,5mm. |
3159965 | Endoprothèse coronaire, stent lib. biolimus, CARDINAL, LUMENO FREE, DIAM 4,0 mm. |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0087 du 13 avril 2021 Texte n° 23
Arrêté du 7 avril 2021 portant modification des références du moniteur ECG implantable REVEAL XT de la société MEDTRONIC France inscrites au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0087 du 13 avril 2021 Texte n° 21
Arrêté du 7 avril 2021 portant changement de distributeur de la prothèse totale du disque lombaire LP ESP II de la société FH ORTHOPEDICS inscrite au titre III de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
JORF n°0083 du 8 avril 2021 Texte n° 38
Arrêté du 6 avril 2021 pris en application de l’article L.162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
a) A l’annexe de l’arrêté du 2 mars 2005, à la fin de la liste, après la référence « Titre V, chapitre 2, section 5 », est créée une nouvelle rubrique ainsi libellée :
«
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 2, section 6 | Dispositifs d’assistance mécanique électrique percutanée |
» ;
b) A l’annexe de l’arrêté du 2 mars 2005, dans la nouvelle rubrique, le code suivant est ajouté :
«
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 2, section 6 | 5271206 | Dispositifs d’assistance mécanique électrique percutanée |
».
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0083 du 8 avril 2021 Texte n° 37
Arrêté du 6 avril 2021 portant inscription du dispositif d’assistance mécanique électrique percutanée, à flux axial, monoventriculaire gauche, de courte durée IMPELLA 5.0 de la société ABIOMED au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre V de la liste des produits et prestations remboursables, chapitre 2, est insérée la section suivante :
«
CODE | NOMENCLATURE |
|---|---|
Section 6 Dispositifs d’assistance mécanique électrique percutanée | |
Société ABIOMED | |
5271206 | Dispositif assist méca élect monoventric gche, flux axial, ABIOMED, IMPELLA 5.0 Dispositif d’assistance mécanique électrique percutanée, à flux axial, monoventriculaire gauche, de courte durée IMPELLA 5.0 de la société ABIOMED. DESCRIPTION Le dispositif IMPELLA 5.0 est une micro-pompe axiale électrique intravasculaire, correspondant à une vis d’Archimède montée dans un cathéter. Une hélice (turbine) entrainée par un moteur électrique embarqué, assure l’écoulement du sang via la canule, de l’orifice d’aspiration dans le ventricule gauche vers l’orifice d’éjection dans l’aorte ascendante. IMPELLA 5.0 fournit une assistance circulatoire mécanique temporaire continue non pulsatile. INDICATION PRISE EN CHARGE Prise en charge de l’adulte en état de choc cardiogénique (CC) réfractaire au traitement médical optimal sans défaillance respiratoire réfractaire nécessitant une assistance respiratoire extracorporelle et sans une défaillance multi-viscérale sévère, survenant à la suite d’une chirurgie cardiaque. MODALITÉS DE PRESCRIPTION ET D’UTILISATION L’utilisation de IMPELLA 5.0 est limitée à des centres tertiaires, disposant d’une activité de chirurgie cardiaque et satisfaisant à des critères de moyens, de compétences et d’organisation. Chaque centre doit disposer : – D’une unité de traitement de l’insuffisance cardiaque (IC) avec au moins 2 cardiologues ; – D’une équipe chirurgicale formée à l’assistance circulatoire mécanique : 2 chirurgiens cardiaques, 2 anesthésistes réanimateurs, 2 perfusionnistes et 1 équipe paramédicale ; – D’un comité pluridisciplinaire (cardiologues, chirurgiens cardiaques, anesthésistes réanimateurs, perfusionnistes, psychologue), dédié à l’ACM, mis en place pour discuter de l’opportunité d’une escalade thérapeutique ; – De plusieurs dispositifs d’assistance circulatoire mécanique ventriculaire (VAD) dans le centre, dont 1 au moins adapté aux petites surfaces corporelles ; – d’une continuité des soins (7J/7) et 24h/24. – Formation et expérience : L’équipe médico-chirurgicale doit acquérir (ou avoir acquis) et maintenir la connaissance nécessaire à l’implantation, à la surveillance et à l’ablation du dispositif d’assistance circulatoire mécanique percutané IMPELLA 5.0. Une formation spécifique initiale doit être dispensée à l’ensemble de l’équipe médico-chirurgicale. – Autorisations d’activité requises : Les centres utilisateurs du dispositif IMPELLA 5.0 doivent disposer de l’autorisation d’activité de chirurgie cardiaque. RÉFÉRENCES PRISES EN CHARGE Le dispositif IMPELLA 5.0 est proposé dans un kit d’implantation. KIT IMPELLA (Référence 005060) comprenant : – Cathéter IMPELLA 5.0 : Référence 004680 ; – Cassette de purge : Référence 0043-0001 ; – Guide de mise en place : Référence 0052-3005 ; – Câble de connexion : Référence 0042-0002 ; – Paire de bouchons en silicone : Référence 0046-3028 ; – Kit d’insertion axillaire (Référence 0052-3009-EU) incluant : – 1 Introducteur pelable de 23 Fr ; – 2 verrous d’implants ; – 1 Dilatateur de 8 Fr à revêtement en silicone. Date de fin de prise en charge : 15 avril 2026. |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0082 du 7 avril 2021 Texte n° 11
Arrêté du 1er avril 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
L’indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie, pour les spécialités visées ci-dessous, concerne uniquement les patients adultes atteints de migraine sévère avec au moins 8 jours de migraine par mois, en échec à au moins deux traitements prophylactiques et sans atteinte cardiovasculaire (patients ayant eu une maladie cardiovasculaire ou une ischémie vasculaire cliniquement significatives, ou événement thromboembolique).
Code CIP | Présentation |
|---|---|
34009 301 745 9 3 | AJOVY 225 mg (frémanezumab), solution injectable en seringue préremplie, seringue préremplie (verre) de 1,5 ml (150 mg/ml) (B/1) (laboratoires TEVA SANTE) |
34009 301 987 4 2 | AJOVY 225 mg (frémanezumab), solution injectable en stylo prérempli, stylo prérempli (verre) de 1,5 ml (150 mg/ml) (B/1) (laboratoires TEVA SANTE) |
JORF n°0079 du 2 avril 2021 Texte n° 26
Arrêté du 30 mars 2021 relatif à l’arrêt de la prise en charge de spécialités pharmaceutiques au titre de l’article L. 162-16-5-2 du code de la sécurité sociale
Il est mis fin à la prise en charge des spécialités pharmaceutiques bénéficiant d’une prise en charge au titre du « post-ATU » mentionnée au I de l’article L. 162-16-5-2 du code de la sécurité sociale conformément aux dispositions qui figurent en annexe.
ANNEXE
(2 arrêts de prise en charge)
A compter du 1er avril 2021, il est mis fin à la prise en charge mentionnée au I de l’article L. 162-16-5-2 du code de la sécurité sociale des spécialités pharmaceutiques mentionnées ci-dessous :
Spécialité pharmaceutique | Indication thérapeutique | Code UCD 7 | Libellé de l’UCD | Laboratoire exploitant |
|---|---|---|---|---|
PIQRAY 250 mg, comprimé pelliculé | En association avec le fulvestrant pour le traitement d’hommes et de femmes ménopausées atteints d’un cancer du sein localement avancé ou métastatique : – porteurs de la mutation PIK3CA -RH positif – HER2-négatif – après échec d’au moins 2 lignes de traitements en situation métastatique incluant un anti-aromatase et un inhibiteur CDK4/6 sauf s’ils n’étaient pas éligibles à ce type de traitement. Si le ou la patient(e) n’est pas éligible à au moins 2 lignes des traitements disponibles en situation métastatique, une justification devra être apportée pour l’accès à alpelisib, – ne présentant pas de propagation viscérale symptomatique, – ne présentant pas de cancer du sein inflammatoire. | 9000603 | PIQRAY 250MG (200+50) CPR | Novartis Pharma S.A.S. |
PIQRAY 200 mg, comprimé pelliculé | 9000602 | PIQRAY 200MG CPR | Novartis Pharma S.A.S. |
JORF n°0079 du 2 avril 2021 Texte n° 25
Arrêté du 29 mars 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une autorisation temporaire d’utilisation et pris en application de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code
En application de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code et dans le cadre de l’autorisation temporaire d’utilisation de cohorte mentionnée à l’article L. 5121-12 du code de la santé publique dont elles ont fait l’objet, les spécialités pharmaceutiques mentionnées en annexe du présent arrêté est prise en charge par l’assurance maladie, dans l’indication mentionnée dans ladite annexe.
Les spécialités pharmaceutiques qui figurent en annexe, pour l’indication mentionnée dans ladite annexe, sont fournies, achetées, utilisées et prises en charge par les établissements de santé conformément à l’article L. 5123-2 du code de la santé publique au titre de cette autorisation temporaire d’utilisation.
Les spécialités pharmaceutiques qui figurent en annexe sont soumises à prescription hospitalière. Cette prescription est réservée aux médecins spécialistes en oncologie ou aux médecins compétents en cancérologie. Conformément à l’arrêté du 11 octobre 2019 susmentionné et en application du III de l’article R. 163-32-1 du code de la sécurité sociale, le prescripteur indique sur l’ordonnance la mention : « La prise en charge de cette spécialité intervient dans le cadre d’une prise en charge “précoce” par l’assurance maladie. A ce titre, cette prise en charge ne peut être que transitoire. »
ANNEXE
(3 spécialités)
Les spécialités suivantes sont prises en charge au titre de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code dans l’indication thérapeutique suivante :
– en association à l’ipilimumab/ nivolumab, en première ligne, dans le traitement des patients adultes atteints d’un mésothéliome pleural malin non résécable.
Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
Nivolumab | OPDIVO 10 mg/mL solution à diluer pour perfusion | 3400894389798 | OPDIVO 10MG/ML PERF FL24ML | Bristol-Myers Squibb |
Nivolumab | OPDIVO 10 mg/mL solution à diluer pour perfusion | 3400894094692 | OPDIVO 10MG/ML PERF FL4ML | Bristol-Myers Squibb |
Ipilimumab | YERVOY 5 mg/mL solution à diluer pour perfusion | 3400893740507 | YERVOY 5MG/ML PERF FL10ML | Bristol-Myers Squibb |
JORF n°0079 du 2 avril 2021 Texte n° 24
Arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(14 inscriptions)
1. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
Chez les patients diabétiques de type 2, VELMETIA 50 mg/1000 mg est indiqué pour améliorer le contrôle de la glycémie, en complément du régime alimentaire et de l’exercice physique :
– chez les patients insuffisamment contrôlés par la metformine seule à la dose maximale tolérée ou chez les patients déjà traités par l’association sitagliptine/metformine ;
– en association à un sulfamide hypoglycémiant (trithérapie) lorsque les doses maximales tolérées de metformine et de sulfamide ne permettent pas d’obtenir un contrôle adéquat de la glycémie ;
– en addition à l’insuline lorsqu’une dose stable d’insuline avec régime alimentaire et exercice physique ne permet pas d’obtenir un contrôle adéquat de la glycémie.
Code CIP | Présentation |
|---|---|
34009 300 009 2 2 | VELMETIA 50 mg/1000 mg (sitagliptine, metformine), comprimés pelliculés (B/60) (laboratoires PIERRE FABRE MEDICAMENT) |
2. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
Chez les patients diabétiques de type 2, XELEVIA 50 mg est indiqué pour améliorer le contrôle de la glycémie :
En monothérapie :
– chez les patients insuffisamment contrôlés par le régime alimentaire et l’exercice physique seuls et pour lesquels la metformine est contre-indiquée ou n’est pas tolérée.
En bithérapie orale, en association à :
– la metformine, lorsque celle-ci, utilisée en monothérapie avec régime alimentaire et exercice physique, ne permet pas d’obtenir un contrôle adéquat de la glycémie ;
– un sulfamide hypoglycémiant, lorsque celui-ci, utilisé en monothérapie, à la dose maximale tolérée, avec régime alimentaire et exercice physique, ne permet pas d’obtenir un contrôle adéquat de la glycémie et lorsque la metformine est contre-indiquée ou n’est pas tolérée.
En trithérapie orale, en association à :
– un sulfamide hypoglycémiant et à la metformine, lorsqu’une bithérapie avec ces deux médicaments avec régime alimentaire et exercice physique ne permet pas d’obtenir un contrôle adéquat de la glycémie ;
– l’insuline et à la metformine, lorsqu’une dose stable d’insuline avec régime alimentaire et exercice physique ne permet pas d’obtenir un contrôle adéquat de la glycémie.
Code CIP | Présentation |
|---|---|
34009 278 875 9 8 | XELEVIA 50 mg (sitagliptine), comprimés pelliculés (B/30) (laboratoires PIERRE FABRE MEDICAMENT) |
3. La spécialité pharmaceutique suivante est inscrite sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour la spécialité visée ci-dessous :
Chez les patients diabétiques de type 2, XELEVIA 100 mg est indiqué pour améliorer le contrôle de la glycémie :
En bithérapie orale, en association à :
– la metformine, lorsque celle-ci, utilisée en monothérapie avec régime alimentaire et exercice physique, ne permet pas d’obtenir un contrôle adéquat de la glycémie ;
– un sulfamide hypoglycémiant, lorsque celui-ci, utilisé en monothérapie, à la dose maximale tolérée, avec régime alimentaire et exercice physique, ne permet pas d’obtenir un contrôle adéquat de la glycémie et lorsque la metformine est contre-indiquée ou n’est pas tolérée.
En trithérapie orale, en association à :
– un sulfamide hypoglycémiant et à la metformine, lorsqu’une bithérapie avec ces deux médicaments avec régime alimentaire et exercice physique ne permet pas d’obtenir un contrôle adéquat de la glycémie ;
– l’insuline et à la metformine, lorsqu’une dose stable d’insuline avec régime alimentaire et exercice physique ne permet pas d’obtenir un contrôle adéquat de la glycémie.
Code CIP | Présentation |
|---|---|
34009 278 876 5 9 | XELEVIA 100 mg (sitagliptine), comprimés pelliculés (B/30) (laboratoires PIERRE FABRE MEDICAMENT) |
4. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 302 063 1 7 | ACICLOVIR ACCORD 25 mg/ml, solution à diluer pour perfusion, 10 ml en flacon (B/5) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 063 2 4 | ACICLOVIR ACCORD 25 mg/ml, solution à diluer pour perfusion, 20 ml en flacon (B/5) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 103 6 9 | EUCREAS 50 mg/1000 mg (vildagliptine, metformine), comprimés pelliculés sous plaquette thermoformée (PVC/PE/PVDC/alu) (B/60) (laboratoires NOVARTIS PHARMA SAS) |
34009 302 127 4 5 | RESELIP 10 mg/10 mg (ésétimibe, atorvastatine), comprimés sous plaquettes (B/30) (laboratoires BOUCHARA RECORDATI) |
34009 302 127 5 2 | RESELIP 10 mg/10 mg (ésétimibe, atorvastatine), comprimés sous plaquettes (B/90) (laboratoires BOUCHARA RECORDATI) |
34009 302 127 6 9 | RESELIP 10 mg/20 mg (ésétimibe, atorvastatine), comprimés sous plaquettes (B/30) (laboratoires BOUCHARA RECORDATI) |
34009 302 127 7 6 | RESELIP 10 mg/20 mg (ésétimibe, atorvastatine), comprimés sous plaquettes (B/90) (laboratoires BOUCHARA RECORDATI) |
34009 302 127 8 3 | RESELIP 10 mg/40 mg (ésétimibe, atorvastatine), comprimés sous plaquettes (B/30) (laboratoires BOUCHARA RECORDATI) |
34009 302 127 9 0 | RESELIP 10 mg/40 mg (ésétimibe, atorvastatine), comprimés sous plaquettes (B/90) (laboratoires BOUCHARA RECORDATI) |
34009 302 128 0 6 | RESELIP 10 mg/80 mg (ésétimibe, atorvastatine), comprimés sous plaquettes (B/30) (laboratoires BOUCHARA RECORDATI) |
34009 302 128 1 3 | RESELIP 10 mg/80 mg (ésétimibe, atorvastatine), comprimés sous plaquettes (B/90) (laboratoires BOUCHARA RECORDATI) |
DEUXIÈME PARTIE
(6 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit :
Libellés abrogés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 279 226 4 0 | NICOPASS CITRON 2 mg SANS SUCRE, gomme à mâcher médicamenteuse édulcorée au xylitol, à l’acésulfame potassique, au sucralose et au maltitol, gommes à mâcher sous plaquette (s) (PVC/PVdC/Aluminium) (B/96) (Laboratoires PIERRE FABRE MEDICAMENT) | 34009 279 226 4 0 | NICOTINE EUROGENERICS CITRON 2 mg SANS SUCRE, gomme à mâcher médicamenteuse édulcorée au xylitol, à l’acésulfame potassique, au sucralose et au maltitol, gommes à mâcher sous plaquette(s) (PVC/PVdC/Aluminium) (B/96) (Laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 279 237 6 0 | NICOPASS CITRON 4 mg SANS SUCRE, gomme à mâcher médicamenteuse édulcorée au xylitol, à l’acésulfame potassique, au sucralose et au maltitol, gommes à mâcher sous plaquette (s) (PVC/PVdC/Aluminium) (B/96) (Laboratoires PIERRE FABRE MEDICAMENT) | 34009 279 237 6 0 | NICOTINE EUROGENERICS CITRON 4 mg SANS SUCRE, gomme à mâcher médicamenteuse édulcorée au xylitol, à l’acésulfame potassique, au sucralose et au maltitol, gommes à mâcher sous plaquette(s) (PVC/PVdC/Aluminium) (B/96) (Laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 279 248 8 0 | NICOPASS MENTHE 2 mg SANS SUCRE (nicotine), gomme à mâcher médicamenteuse édulcorée au xylitol, à l’acésulfame potassique, au sucralose et au maltitol, gommes à mâcher sous plaquette (s) (PVC/PVdC/Aluminium) (B/96) (Laboratoires PIERRE FABRE MEDICAMENT) | 34009 279 248 8 0 | NICOTINE EUROGENERICS MENTHE 2 mg SANS SUCRE, gomme à mâcher médicamenteuse édulcorée au xylitol, à l’acésulfame potassique, au sucralose et au maltitol, gommes à mâcher sous plaquette(s) (PVC/PVdC/Aluminium) (B/96) (Laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 279 258 3 2 | NICOPASS MENTHE 4 mg SANS SUCRE (nicotine), gomme à mâcher médicamenteuse édulcorée au xylitol, à l’acésulfame potassique, au sucralose et au maltitol, gommes à mâcher sous plaquette (s) (PVC/PVdC/Aluminium) (B/96) (Laboratoires PIERRE FABRE MEDICAMENT) | 34009 279 258 3 2 | NICOTINE EUROGENERICS MENTHE 4 mg SANS SUCRE, gomme à mâcher médicamenteuse édulcorée au xylitol, à l’acésulfame potassique, au sucralose et au maltitol, gommes à mâcher sous plaquette(s) (PVC/PVdC/Aluminium) (B/96) (Laboratoires EG LABO LABORATOIRES EUROGENERICS) |
34009 307 024 8 2 | NATULAN 50 mg (chlorhydrate de procarbazine), gélules (B/50) (Laboratoires SIGMA-TAU FRANCE) | 34009 307 024 8 2 | NATULAN 50 mg (chlorhydrate de procarbazine), gélules (B/50) (Laboratoires LEADIANT BIOSCIENCES SAS) |
34009 300 087 7 5 | NATULAN 50 mg (chlorhydrate de procarbazine), gélules sous plaquettes (aluminium/aluminium) (B/50) (Laboratoires SIGMA-TAU FRANCE) | 34009 300 087 7 5 | NATULAN 50 mg (chlorhydrate de procarbazine), gélules sous plaquettes (aluminium/aluminium) (B/50) (Laboratoires LEADIANT BIOSCIENCES SAS) |
JORF n°0077 du 31 mars 2021 Texte n° 25
Arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge des spécialités ci-dessous est étendue à l’indication suivante :
– traitement de la dermatite atopique modérée à sévère de l’adulte qui nécessite un traitement systémique uniquement en cas d’échec, d’intolérance ou de contre-indication à la ciclosporine.
Code CIP | Présentation |
|---|---|
34009 300 873 6 7 | OLUMIANT 2 mg (baricitinib), comprimés pelliculés (B/28) (laboratoires LILLY FRANCE SAS) |
34009 550 307 5 1 | OLUMIANT 2 mg (baricitinib), comprimés pelliculés (B/84) (laboratoires LILLY FRANCE SAS) |
34009 300 873 9 8 | OLUMIANT 4 mg (baricitinib), comprimés pelliculés (B/28) (laboratoires LILLY FRANCE SAS) |
34009 550 308 0 5 | OLUMIANT 4 mg (baricitinib), comprimés pelliculés (B/84) (laboratoires LILLY FRANCE SAS) |
JORF n°0076 du 30 mars 2021 Texte n° 33
Arrêté du 29 mars 2021 modifiant l’arrêté du 2 mars 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une recommandation temporaire d’utilisation et pris en application de l’article L. 162-17-2-1 du code de la sécurité sociale
Dans l’article 2 de l’arrêté du 2 mars 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une recommandation temporaire d’utilisation et pris en application de l’article L. 162-17-2-1 du code de la sécurité sociale publié au Journal officiel du 4 mars 2021, (NOR : SSAS2103530A, texte n° 22), les mots : « La spécialité pharmaceutique dans les indications mentionnées en annexe du présent arrêté est soumise à prescription hospitalière » et « endocrinologues pédiatres » sont remplacés respectivement par les mots : « La prescription de la spécialité pharmaceutique dans les indications mentionnées en annexe du présent arrêté est » et « endocrinologie pédiatrie ».
JORF n°0076 du 30 mars 2021 Texte n° 32
Arrêté du 26 mars 2021 pris en application de l’article L. 162-22-7 du code de la sécurité sociale et modifiant l’arrêté du 2 mars 2005 modifié fixant la liste des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale pris en charge en sus des prestations d’hospitalisation
a) A l’annexe de l’arrêté du 2 mars 2005, à la fin de la liste, après la référence « Titre V, chapitre 4, section 1 », est créée une nouvelle rubrique ainsi libellée :
«
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 4, section 2 | Endoprothèse oesophagienne |
» ;
b) A l’annexe de l’arrêté du 2 mars 2005, dans la nouvelle rubrique, le code suivant est ajouté :
«
Référence dans la LPP | Code | Libellé |
|---|---|---|
Titre V, chapitre 4, section 2 | 5442168 | Endoprothèse oesophagienne |
».
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0076 du 30 mars 2021 Texte n° 31
Arrêté du 26 mars 2021 portant inscription de l’endoprothèse oesophagienne DANIS STENT de la société NOVATECH au titre V de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
Au titre V de la liste des produits et prestations remboursables, chapitre 4, une section 2 est ajoutée comme suit :
CODE | NOMENCLATURE |
|---|---|
Section 2 Endoprothèse oesophagienne | |
Société NOVATECH | |
5442168 | Endoprothèse oesophagienne, auto-expansible, couverte, NOVATECH, DANIS STENT DESCRIPTION Le SX-ELLA Stent Danis est fourni sous la forme d’un set de procédure unitaire stérile comprenant : – 1 prothèse SX-ELLA Danis (modèle 08S) préchargée dans son système de pose ; – 1 système de pose dans lequel est préchargé la prothèse SX-ELLA Danis ; – 1 seringue en plastique ; – 1 fil guide, ultra rigide avec extrémité souple ; – 1 mode d’emploi ; – 1 carte d’identification pour le patient. INDICATION PRISE EN CHARGE Traitement d’urgence des hémorragies aiguës abondantes, incontrôlées et réfractaires liées à la rupture de varices œsophagiennes du patient cirrhotique. L’hémorragie est qualifiée de réfractaire en cas d’échec du traitement médical conventionnel (pharmacologique et endoscopique). La pose de SX-ELLA Stent Danis constitue un traitement temporaire des patients en vue de la programmation d’un shunt porto-systémique intrahépatique par voie transjugulaire (Transjugular Intrahepatic Portosystemic Shunt : TIPS). MODALITÉS DE PRESCRIPTION ET D’UTILISATION La prise en charge de DANIS STENT est assurée dans la limite d’une unité au maximum par procédure. La prise en charge est recommandée sous réserve des conditions suivantes : – mention dans le dossier médical du patient de la date d’implantation et de l’identification de la prothèse de SX-ELLA Stent Danis ; – programmation d’un shunt porto-systémique intrahépatique par voie transjugulaire (TIPS) dès l’arrêt des saignements œsophagiens. Formation : Seul un médecin possédant la formation appropriée peut réaliser l’implantation et l’extraction (retrait) de la prothèse. Environnement technique : L’hospitalisation doit se faire dans un établissement comportant au moins une unité de soins intensifs et un plateau technique d’endoscopie digestive comprenant du matériel de radiologie (salle d’endoscopie interventionnelle). Modalités d’implantation et d’extraction de la prothèse : – l’implantation de la prothèse de SX-ELLA Stent Danis doit être effectuée à l’aide d’un fil guide sous contrôle endoscopique ou radiographique avec une vérification du bon positionnement de la prothèse par contrôle endoscopique et radiographique ; – l’extraction de la prothèse par ELLA Extractor doit être réalisée sous double contrôle endoscopique et radioscopique (par fluoroscopie). La prothèse de SX-ELLA Stent Danis doit être retirée au maximum dans les 7 jours suivant la date d’implantation et immédiatement après l’implantation d’un TIPS, au cours de la même intervention. Si la prothèse n’arrête pas l’hémorragie, réévaluer les conditions et retirer la prothèse 48 heures au plus tard. RÉFÉRENCE PRISE EN CHARGE SX-ELLA Stent Danis : 019-08S-25-135B Le ELLA Extractor ne peut faire l’objet d’une prise en charge avec ce code de facturation. Date de fin de prise en charge : 15 avril 2026. |
Le présent arrêté prend effet à compter du treizième jour suivant la date de sa publication au Journal officiel.
JORF n°0076 du 30 mars 2021 Texte n° 30
Arrêté du 25 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités mentionnées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté, à l’exception de l’indication suivante :
– Choc polytraumatique / prophylaxie du syndrome pulmonaire de choc post-traumatique.
Code CIP | Présentation |
|---|---|
34009 550 771 6 9 | DEXAMETHASONE PANPHARMA 20 mg/5 ml, solution injectable, 5 ml en ampoule (verre) (B/10) (laboratoires PANPHARMA) |
34009 550 771 4 5 | DEXAMETHASONE PANPHARMA 4 mg/ml, solution injectable, 1 ml en ampoule (verre) (B/10) (laboratoires PANPHARMA) |
JORF n°0076 du 30 mars 2021 Texte n° 29
Arrêté du 25 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– Traitement en monothérapie et en association des crises partielles avec ou sans généralisation secondaire chez les enfants à partir de 4 ans présentant une épilepsie.
Code CIP | Présentation |
|---|---|
34009 388 309 8 9 | VIMPAT 10 mg/ml (lacosamide), solution pour perfusion en flacon (B/1) (laboratoires UCB PHARMA SA) |
JORF n°0076 du 30 mars 2021 Texte n° 28
Arrêté du 24 mars 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d’une autorisation de mise sur le marché inscrites sur la liste visée à l’article L. 5126-6 du code de la santé publique
La prise en charge de la spécialité rétrocédable ci-dessous est étendue dans l’indication suivante :
– Traitement des manifestations neurologiques progressives des patients adultes et des enfants atteints de maladie de Niemann-Pick type C.
Code UCD | Libellé | Laboratoire exploitant |
|---|---|---|
34008 943 791 6 4 | MIGLUSTAT GOH 100MG GELU | GEN.ORPH |
JORF n°0076 du 30 mars 2021 Texte n° 27
Arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– Traitement des manifestations neurologiques progressives des patients adultes et des enfants atteints de maladie de Niemann-Pick type C.
Code CIP | Présentation |
|---|---|
34009 301 309 6 4 | MIGLUSTAT GEN.ORPH 100 mg, gélule, plaquette thermoformée (OPA/alu/PVC) (B/84) (laboratoires GEN.ORPH) |
JORF n°0076 du 30 mars 2021 Texte n° 26
Arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
PREMIÈRE PARTIE
(26 Inscriptions)
1. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
– Traitement des patients adultes atteints de leucémie aiguë lymphoblastique (LAL Ph+) en cas de résistance ou intolérance à un traitement antérieur.
– Traitement des patients pédiatriques atteints de leucémie myéloïde chronique (LMC) à chromosome Philadelphie positive (Ph+) en phase chronique, résistants ou intolérants à l’imatinib,
– Traitement des patients pédiatriques atteints de leucémie aiguë lymphoblastique à Chromosome Philadelphie (LAL Ph+) nouvellement diagnostiquée en association à une chimiothérapie.
Code CIP | Présentation |
|---|---|
34009 302 197 9 9 | DASATINIB BIOGARAN 100 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 302 198 2 9 | DASATINIB BIOGARAN 140 mg, comprimés pelliculés (B/30) (laboratoires BIOGARAN) |
34009 302 196 9 0 | DASATINIB BIOGARAN 20 mg, comprimés pelliculés (B/60) (laboratoires BIOGARAN) |
34009 302 197 3 7 | DASATINIB BIOGARAN 50 mg, comprimés pelliculés (B/60) (laboratoires BIOGARAN) |
34009 302 197 6 8 | DASATINIB BIOGARAN 70 mg, comprimés pelliculés (B/60) (laboratoires BIOGARAN) |
2. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est pour les spécialités visées ci-dessous :
– Traitement de l’hyperparathyroïdie (HPT) secondaire chez les enfants âgés de 3 ans et plus, dialysés, atteints d’insuffisance rénale chronique terminale (IRCT) chez qui l’HPT secondaire n’est pas correctement contrôlée par les traitements de référence.
Code CIP | Présentation |
|---|---|
34009 301 722 2 3 | CINACALCET BGR 30 mg, comprimés pelliculés (B/28) (laboratoires BIOGARAN) |
34009 301 722 0 9 | CINACALCET BGR 60 mg, comprimés pelliculés (B/28) (laboratoires BIOGARAN) |
34009 301 721 7 9 | CINACALCET BGR 90 mg, comprimés pelliculés (B/28) (laboratoires BIOGARAN) |
3. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont pour les spécialités visées ci-dessous :
– Traitement des sinusites aiguës bactériennes (correctement documentées),
– Traitements des exacerbations aiguës de bronchite chronique (correctement documentées),
– Traitement des pneumonies communautaires à l’exception des formes sévères.
Code CIP | Présentation |
|---|---|
34009 278 550 2 3 | MOXIFLOXACINE MYLAN 400 mg, comprimés pelliculés sous plaquette prédécoupée unitaire (PVC/Aluminium/OPA-Aluminium) (B/5) (laboratoires MYLAN SAS) |
34009 278 551 9 1 | MOXIFLOXACINE MYLAN 400 mg, comprimés pelliculés sous plaquette prédécoupée unitaire (PVC/Aluminium/OPA-Aluminium) (B/7) (laboratoires MYLAN SAS) |
4. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont pour les spécialités visées ci-dessous :
– chez l’adulte, dans le traitement des douleurs neuropathiques périphériques et centrales ;
– chez l’adulte, en association, dans le traitement des crises épileptiques partielles avec ou sans généralisation secondaire.
Code CIP | Présentation |
|---|---|
34009 302 132 5 4 | PREGABALINE ALTER 25 mg, gélules (B/56) (laboratoires ALTER) |
34009 302 132 6 1 | PREGABALINE ALTER 25 mg, gélules (B/84) (laboratoires ALTER) |
5. Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics.
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
Code CIP | Présentation |
|---|---|
34009 417 306 8 9 | ATORVASTATINE ALTER 40 mg, comprimés pelliculés (B/90) (laboratoires ALTER) |
34009 301 454 6 3 | DESOGESTREL MYLAN PHARMA 75 microgrammes, comprimés, 1 plaquette (PVC/PVDC/Aluminium) suremballée de 28 (laboratoires MYLAN SAS) |
34009 301 454 7 0 | DESOGESTREL MYLAN PHARMA 75 microgrammes, comprimés, 3 plaquettes (PVC/PVDC/Aluminium) suremballées de 28 (laboratoires MYLAN SAS) |
34009 302 125 4 7 | DIVALCOTE (Divalproate de sodium) 250 mg, comprimés gastro-résistants Gé (B/30) (laboratoires MYLAN SAS) |
34009 301 955 0 5 | DIVALCOTE (Divalproate de sodium) 250 mg, comprimés gastro-résistants Gé sous plaquettes unitaires (Alu/Alu)(B/30) (laboratoires MYLAN SAS) |
34009 302 125 7 8 | DIVALCOTE (Divalproate de sodium) 500 mg, comprimés gastro-résistants Gé (B/90) (laboratoires MYLAN SAS) |
34009 301 955 7 4 | DIVALCOTE (Divalproate de sodium) 500 mg, comprimés gastro-résistants Gé sous plaquettes unitaires (Alu/Alu)(B/90) (laboratoires MYLAN SAS) |
34009 300 739 6 4 | EZETIMIBE ALTER 10 mg, comprimés (B/30) (laboratoires ALTER) |
34009 300 649 6 2 | FONDAPARINUX SODIQUE REDDY PHARMA 10 mg/0,8 ml, solution injectable en seringue pré-remplie (B/10) (laboratoires REDDY PHARMA SAS) |
34009 300 647 0 2 | FONDAPARINUX SODIQUE REDDY PHARMA 2,5 mg/0,5 ml, solution injectable en seringue pré-remplie (B/10) (laboratoires REDDY PHARMA SAS) |
34009 300 648 0 1 | FONDAPARINUX SODIQUE REDDY PHARMA 5 mg/0,4 ml, solution injectable en seringue pré-remplie (B/10) (laboratoires REDDY PHARMA SAS) |
34009 300 648 9 4 | FONDAPARINUX SODIQUE REDDY PHARMA 7,5 mg/0,6 ml, solution injectable en seringue pré-remplie (B/10) (laboratoires REDDY PHARMA SAS) |
34009 302 029 7 5 | URAPIDIL MYLAN LP 30 mg, gélules à libération prolongée en flacon (B/30) (laboratoires MYLAN SAS) |
34009 302 030 1 9 | URAPIDIL MYLAN LP 60 mg, gélules à libération prolongée en flacon (B/30) (laboratoires MYLAN SAS) |
SECONDE PARTIE
(Extensions d’indications)
La prise en charge des spécialités ci-dessous est étendue aux indications suivantes :
– Traitement des patients pédiatriques atteints de leucémie myéloïde chronique (LMC) à chromosome Philadelphie positive (Ph+) en phase chronique, résistants ou intolérants à l’imatinib,
– Traitement des patients pédiatriques atteints de leucémie aiguë lymphoblastique à Chromosome Philadelphie (LAL Ph+) nouvellement diagnostiquée en association à une chimiothérapie.
Code CIP | Présentation |
|---|---|
34009 301 639 8 6 | DASATINIB SANDOZ 100 mg, comprimés pelliculés (B/30) (laboratoires SANDOZ) |
34009 301 639 2 4 | DASATINIB SANDOZ 140 mg, comprimés pelliculés (B/30) (laboratoires SANDOZ) |
34009 301 641 7 4 | DASATINIB SANDOZ 20 mg, comprimés pelliculés (B/60) (laboratoires SANDOZ) |
34009 301 641 3 6 | DASATINIB SANDOZ 50 mg, comprimés pelliculés (B/60) (laboratoires SANDOZ) |
34009 301 640 5 1 | DASATINIB SANDOZ 70 mg, comprimés pelliculés (B/60) (laboratoires SANDOZ) |
TROISIÈME PARTIE
(2 modifications)
Le libellé des spécialités pharmaceutiques suivantes est modifié comme suit.
Libellés abrogés | Nouveaux libellés | ||
|---|---|---|---|
Code CIP | Libellé | Code CIP | Libellé |
34009 302 074 2 0 | CICLOPIROX OLAMINE VENIPHARM 1%, crème, 30 g en tube (Laboratoires VENIPHARM) | 34009 302 074 2 0 | CICLOPIROX OLAMINE MYLAN 1%, crème, 30 g en tube (Laboratoires MYLAN SAS) |
34009 300 834 2 0 | ABACAVIR/LAMIVUDINE 600 mg/300 mg, comprimés pelliculés (B/30) (Laboratoires ACCORD HEALTHCARE FRANCE SAS) | 34009 300 834 2 0 | ABACAVIR/LAMIVUDINE ACCORD 600 mg/300 mg, comprimés pelliculés (B/30) (Laboratoires ACCORD HEALTHCARE FRANCE SAS) |
(Rectificatif)
Dans l’arrêté du 28 janvier 2021 modifiant la liste des spécialités pharmaceutiques agréés à l’usage des collectivités et divers services publics (NOR : SSAS2100683A, texte n° 6), publié au Journal officiel du 2 mars 2021, pour les spécialités visées ci-dessous, les indications thérapeutiques prises en charge par l’assurance maladie sont rectifiées comme suit :
Au lieu de :
« Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
Hypercholestérolémie :
EZETIMIBE/SIMVASTATINE ALMUS est indiqué comme traitement adjuvant au régime chez les patients ayant une hypercholestérolémie primaire (familiale hétérozygote et non familiale) ou une dyslipidémie mixte lorsque l’utilisation d’une association est appropriée :
– patients non contrôlés de façon appropriée par une statine seule ;
– patients recevant déjà une statine et de l’ézétimibe.
Hypercholestérolémie familiale homozygote (HFHo) :
EZETIMIBE/SIMVASTATINE ALMUS est indiqué comme traitement adjuvant au régime chez les patients ayant une HFHo.
Ces patients peuvent recevoir également des traitements adjuvants (exemple : aphérèse des LDL). »
Lire :
« Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous :
Hypercholestérolémie :
EZETIMIBE/SIMVASTATINE ACCORD est indiqué comme traitement adjuvant au régime chez les patients ayant une hypercholestérolémie primaire (familiale hétérozygote et non familiale) ou une dyslipidémie mixte lorsque l’utilisation d’une association est appropriée :
– patients non contrôlés de façon appropriée par une statine seule ;
– patients recevant déjà une statine et de l’ézétimibe.
Hypercholestérolémie familiale homozygote (HFHo) :
EZETIMIBE/SIMVASTATINE ACCORD est indiqué comme traitement adjuvant au régime chez les patients ayant une HFHo.
Ces patients peuvent recevoir également des traitements adjuvants (exemple : aphérèse des LDL). »
Code CIP | Présentation |
|---|---|
34009 302 178 4 9 | EZETIMIBE/SIMVASTATINE ACCORD 10 mg/20 mg, comprimés (B/30) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 178 5 6 | EZETIMIBE/SIMVASTATINE ACCORD 10 mg/20 mg, comprimés (B/90) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 178 6 3 | EZETIMIBE/SIMVASTATINE ACCORD 10 mg/40 mg, comprimés (B/30) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
34009 302 178 8 7 | EZETIMIBE/SIMVASTATINE ACCORD 10 mg/40 mg, comprimés (B/90) (laboratoires ACCORD HEALTHCARE FRANCE SAS) |
JORF n°0073 du 26 mars 2021 Texte n° 29
Arrêté du 25 mars 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une autorisation temporaire d’utilisation et pris en application de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code
En application de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code et dans le cadre de l’autorisation temporaire d’utilisation de cohorte mentionnée à l’article L. 5121-12 du code de la santé publique dont elles ont fait l’objet, les spécialités pharmaceutiques mentionnées en annexe du présent arrêté sont prises en charge par l’assurance maladie, dans l’indication mentionnée dans ladite annexe.
Les spécialités pharmaceutiques qui figurent en annexe, pour l’indication mentionnée dans ladite annexe, sont fournies, achetées, utilisées et prises en charges par les établissements de santé conformément à l’article L. 5123-2 du code de la santé publique au titre de cette autorisation temporaire d’utilisation.
Elles sont vendues au public et au détail, au titre de cette autorisation temporaire d’utilisation, par les seules pharmacies à usage intérieur autorisées, conformément aux dispositions mentionnées aux articles L. 5126-6 et R. 5126-60 du code de la santé publique. Elles donnent lieu à remboursement ou prise en charge dans ce cadre sans participation de l’assuré en application des dispositions de l’article R. 160-8 susvisé.
Les spécialités pharmaceutiques qui figurent en annexe sont soumises à prescription hospitalière. Cette prescription est réservée aux médecins spécialistes en oncologie ou aux médecins compétents en cancérologie. Conformément à l’arrêté du 11 octobre 2019 susmentionné et en application du III de l’article R. 163-32-1 du code de la sécurité sociale, le prescripteur indique sur l’ordonnance la mention : « La prise en charge de cette spécialité intervient dans le cadre d’une prise en charge “précoce” par l’assurance maladie. A ce titre, cette prise en charge ne peut être que transitoire. »
ANNEXE
(2 inscriptions)
La prise en charge au titre de l’article L. 162-16-5-1-1 du code de la sécurité sociale et du I de l’article R. 163-32-1 du même code des spécialités suivantes est étendue à l’indication thérapeutique suivante :
– en monothérapie dans le traitement adjuvant après résection tumorale complète et chimiothérapie adjuvante si indiquée, des patients adultes atteints d’un cancer bronchique non à petites cellules (CBNPC) avec mutations activatrices du récepteur du facteur de croissance épidermique (EGFR) par délétion de l’exon 19 ou substitution de l’exon 21 (L858R) et présentant un score ECOG 0 ou 1.
| Dénomination Commune Internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
| osimertinib | TAGRISSO 40 mg, comprimé pelliculé | 3400894162452 | TAGRISSO 40MG CPR | Astrazeneca |
| osimertinib | TAGRISSO 80 mg, comprimé pelliculé | 3400894162513 | TAGRISSO 80MG CPR | Astrazeneca |
JORF n°0073 du 26 mars 2021 Texte n° 21
Arrêté du 24 mars 2021 portant radiation de spécialités pharmaceutiques de la liste des médicaments agréés à l’usage des collectivités publiques prévue à l’article L. 5123-2 du code de la santé publique
JORF n°0073 du 26 mars 2021 Texte n° 19
Arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
(4 inscriptions)
Les spécialités pharmaceutiques suivantes sont inscrites sur la liste des médicaments agréés à l’usage des collectivités et divers services publics :
Les seules indications thérapeutiques ouvrant droit à la prise en charge par l’assurance maladie sont, pour les spécialités visées ci-dessous, celles qui figurent à l’autorisation de mise sur le marché à la date de publication du présent arrêté.
| Code CIP | Présentation |
|---|---|
| 34009 550 790 0 2 | DICLOFENAC DELBERT 75 mg/3 ml, solution injectable, ampoules en verre de 3 ml (B/10) (laboratoires DELBERT) |
| 34009 302 198 4 3 | DICLOFENAC DELBERT 75 mg/3 ml, solution injectable, ampoules en verre de 3 ml (B/2) (laboratoires DELBERT) |
| 34009 550 790 1 9 | DICLOFENAC DELBERT 75 mg/3 ml, solution injectable, ampoules en verre de 3 ml (B/50) (laboratoires DELBERT) |
La seule indication thérapeutique ouvrant droit à la prise en charge par l’assurance maladie est, pour la spécialité visée ci-dessous :
– En sédation en Unité de Soins Intensifs (USI) chez l’adulte nécessitant un état de sédation pas plus profond que celui permettant une réponse à un stimulus verbal (correspondant à un score de 0 à -3 sur l’échelle de vigilance-agitation de Richmond (RASS)).
| Code CIP | Présentation |
|---|---|
| 34009 550 796 0 6 | DEXMEDETOMIDINE BAXTER 100 microgrammes/ml, solution à diluer pour perfusion, 2 ml en flacon (verre) (B/5) (laboratoires BAXTER SAS) |
(1 extension d’indication)
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– Prévention de l’hémorragie du post-partum due à une atonie après un accouchement par voie basse.
| Code CIP | Présentation |
|---|---|
| 34009 550 002 5 9 | CARBETOCINE AGUETTANT 100 microgrammes/ml, solution injectable en seringue pré-remplie, 1 ml en seringue pré-remplie (verre) (B/5) (laboratoires AGUETTANT) |
(1 modification)
Le libellé de la spécialité pharmaceutique suivante est modifié comme suit.
| Ancien libellé | Nouveau libellé | ||
|---|---|---|---|
| Code CIP | Libellé | Code CIP | Libellé |
| 34009 550 941 2 8 | XYLOCARD 5 mg/ml (chlorhydrate de lidocaïne), solution injectable pour perfusion, 20 ml en flacon (verre) (B/10) (Laboratoires ASPEN FRANCE) | 34009 550 941 2 8 | XYLOCARD 50 mg/ml (chlorhydrate de lidocaïne), solution injectable pour perfusion, 20 ml en flacon (verre) (B/10) (Laboratoires ASPEN FRANCE) |
JORF n°0073 du 26 mars 2021 Texte n° 18
Arrêté du 24 mars 2021 relatif à la prise en charge d’une spécialité pharmaceutique bénéficiant d’une recommandation temporaire d’utilisation et pris en application de l’article L. 162-17-2-1 du code de la sécurité sociale
En application de l’article L. 162-17-2-1 du code de la sécurité sociale et dans le cadre de la recommandation temporaire d’utilisation dont elle fait l’objet, la spécialité pharmaceutique mentionnée en annexe du présent arrêté est prise en charge, pour une durée de trois ans, dans l’indication mentionnée dans ladite annexe.
La spécialité pharmaceutique dans l’indication mentionnée en annexe du présent arrêté est soumise à prescription hospitalière réservée aux spécialistes en hématologie ou en oncologie, ou aux médecins compétents en maladie du sang ou en cancérologie.
L’entreprise exploitant la spécialité pharmaceutique figurant en annexe est tenue de mettre en place le suivi des patients selon les modalités prévues dans le protocole mentionné à l’article R. 5121-76-1 du code de la santé publique.
ANNEXE
| Libellé de la spécialité pharmaceutique prise en charge et laboratoire exploitant | Indication objet de la recommandation temporaire d’utilisation |
|---|---|
| ADCETRIS 50 mg, poudre pour solution à diluer pour perfusion (Brentuximab Vedotin) Laboratoire TAKEDA | Traitement du lymphome de Hodgkin en seconde ligne avant greffe autologue de cellules souches, en association à la chimiothérapie standard chez les enfants, les adolescents et les adultes. |
JORF n°0073 du 26 mars 2021 Texte n° 17
Arrêté du 24 mars 2021 modifiant la liste des spécialités pharmaceutiques prises en charge en sus des prestations d’hospitalisation mentionnée à l’article L. 162-22-7 du code de la sécurité sociale
La prise en charge en sus des prestations d’hospitalisation de la spécialité ci-dessous est étendue à l’indication suivante :
– Le traitement du lymphome anaplasique à grandes cellules systémique (LAGCs) non précédemment traité, en association avec le cyclophosphamide, la doxorubicine et la prednisone (CHP), uniquement en l’absence de mutation ALK (ALK-) ou en présence de la mutation (ALK+) chez les patients ayant un score IPI ≥ 2.
| Dénomination commune internationale | Libellé de la spécialité pharmaceutique | Code UCD | Libellé de l’UCD | Laboratoire exploitant ou titulaire de l’autorisation de mise sur le marché |
|---|---|---|---|---|
| brentuximab vedotin | ADCETRIS 50 mg, poudre pour solution à diluer pour perfusion | 3400893913444 | ADCETRIS 50MG PERF FL | TAKEDA FRANCE SAS |
JORF n°0073 du 26 mars 2021 Texte n° 15
Arrêté du 23 février 2021 modifiant la liste des spécialités pharmaceutiques agréées à l’usage des collectivités et divers services publics
La prise en charge de la spécialité ci-dessous est étendue dans l’indication suivante :
– Traitement du lymphome anaplasique à grandes cellules systémique (LAGCs) non précédemment traité, en association avec le cyclophosphamide, la doxorubicine et la prednisone (CHP), uniquement en l’absence de mutation ALK (ALK-) ou en présence de la mutation (ALK+) chez les patients ayant un score IPI≥2.
| Code CIP | Présentation |
|---|---|
| 34009 583 971 8 9 | ADCETRIS 50 mg (brentuximab vedotin), poudre pour solution pour perfusion, flacon (verre) (B/1) (laboratoires TAKEDA) |
JORF n°0056 du 6 mars 2021 Texte n° 31
Arrêté du 25 février 2021 portant abrogation de l’arrêté 4 février 2021 modifiant l’arrêté du 17 décembre 2004 modifié fixant la liste prévue à l’article L. 5126-4 du code de la santé publique
